
RSS-Feed der Bay. Landesanstalt für Wald und Forstwirtschaft abonnieren
So verpassen Sie keine Neuigkeiten mehr. Unser RSS-Feed "Nachrichten der Bayerischen Landesanstalt für Wald und Forstwirtschaft" informiert Sie kostenlos über unsere aktuellen Beiträge.
Marco Conedera, Jörg Grüner, Horst Delb, Eric Gehring und Simone Prospero
Die wichtigsten Krankheiten und Schädlinge der Edelkastanie – LWF Wissen 81
Die Edelkastanie: eine anfällige Baumart
Alle diese Arten sind prinzipiell interfertil, d. h. sie sind untereinander kreuzbar und das daraus entstehende Geschlecht ist auch fertil. Da die Arten aber schon sehr früh aufgrund der geografischen Gegebenheiten getrennt wurden, haben sie somit auch separate evolutionäre Wege eingeschlagen. Nach Lang et al. (2007) liegt das ursprüngliche Zentrum der Kastanienarten in Asien (China und Japan). Von dort ist die Gattung zunächst über Europa und dann weiter nach Nordamerika divergiert. Die so entstandenen europäischen und amerikanischen Kastanienarten haben sich in der neuen geografischen Umgebung somit ohne den selektiven Druck durch gewisse spezifische Krankheiten und Schädlinge wie den Kastanienrindenkrebs und der Asiatischen Edelkastaniengallwespe weiterentwickelt.
Die hohe Krankheits- und Schädlingsanfälligkeit der extra-asiatischen Kastanienarten wurde offensichtlich, als der Kastanienrindenkrebs und die Asiatische Edelkastaniengallwespe unbeabsichtigt in die entsprechenden Areale eingeschleppt wurden.
In Europa hat die große kulturelle und wirtschaftliche Bedeutung der Edelkastanie, die oft in Reinbeständen kultiviert wurde – und zum Teil immer noch wird (Conedera und Krebs 2008) – die Empfindlichkeit des Systems weiter verschärft. Neben der Baumart selbst haben neue, pandemische Ereignisse und auch die Art der Bewirtschaftung und die damit verbundenen ökosystemischen Dienstleistungen im weiteren Sinne stark darunter gelitten.
In diesem Beitrag präsentieren wir den historischen Verlauf und den aktuellen Stand der drei Hauptgegenspieler der Edelkastanie: die Asiatische Edelkastaniengallwespe (erstmals gemeldet in Europa im Jahr 2002), den Kastanienrindenkrebs (Erstmeldung in Europa im Jahr 1938) und die Tintenkrankheit, eine Kastanienkrankheit, deren Ursprung und Erstmeldung für Europa noch unsicher sind.
Die Asiatische Edelkastaniengallwespe
Biologie und Lebenszyklus
 Zoombild vorhanden
Zoombild vorhanden
Abb. 1: Lebenszyklus der Asiatischen Edelkastaniengallwespe (Dryocosmus kuriphilus) (Fotos: WSL (CH))
Es kommen nur Weibchen vor, die sich parthenogenetisch (ungeschlechtlich) vermehren können. Die erwachsenen Insekten mit einer Größe von 2,5 bis 3,0 mm sind univoltin (eine Generation pro Jahr hervorbringend) und fliegen zwischen Juni und August (Abbildung 1). In ihrem kurzen Leben als flugfähiges Insekt von lediglich bis zu zehn Tagen legen die Gallwespenweibchen etwa einhundert 0,1 mm kleine Eier in neu gebildete Kastanienknospen (Abbildung 1I).
Pro Knospe werden bis zu zwölf Eier gelegt (Abbildung 1J), ohne zunächst auffällige Symptome an den Wirtsbäumen hervorzurufen (Abbildung 1A). Aus den Eiern schlüpfen im Spätsommer oder Herbst weißliche Larven, die im ersten Larvenstadium ohne zu fressen oder zu wachsen in den Knospen überwintern (Abbildung 1F). Im Moment des Austriebs im Folgejahr werden die Larven aktiv und stimulieren die Kastanie zur Bildung von 0,5 bis 2,5 cm großen, glattwandigen, hellgrünen (Abbildung 1B) bis rosaroten Gallen (Abbildung 1C).
Im Innern der Gallen bilden die Larven je eine Kammer (Abbildung 1G), in der sie sich nach wenigen Wochen Fraß auch verpuppen. Die Puppen sind anfangs weiß und gehen mit der Zeit in eine dunkelbraune Färbung über (Abbildung 1H). Von Juni bis Juli schlüpfen die erwachsenen Gallwespen der nächsten Generation und schwärmen auf der Suche nach geeigneten Kastanienknospen für die nächste Eiablage aus (Abbildung 1I). Dabei werden sie durch den Wind unterstützt und können 20 km oder auch weiter fliegen.
Befallssymptome
 Zoombild vorhanden
Zoombild vorhanden
Abb. 2: Stark verlichteter Ast als Folge von wiederholtem Befall der Asiatischen Edelkastaniengallwespe (Fotos: WSL (CH))
Der Baum versucht zu reagieren, indem er die schlafenden Knospen aktiviert und Ersatztriebe ausbildet. Solche Ersatztriebe bleiben im ersten Jahr der Ausbildung noch gesund und befallsfrei, da sie sich in der laufenden Saison entwickeln und somit zum Schwärmzeitpunkt der Gallwespe noch keine Knospen besitzen. Ab dem zweiten Jahr können auch diese befallen werden sowie auch die Augusttriebe, welche sich vermehrt ab dem dritten Befallsjahr als Reaktion auf die Baumschwächung bilden.
Mit den Jahren verursacht das Absterben von befallenen Bereichen, vor allem durch mit Gallen besetzte Triebe, eine Beeinträchtigung der normalen Astarchitektur sowie eine fortschreitende Verlichtung der Krone und das Verkümmern der Bäume (Abbildung 2), die bis zu 70 % ihrer ursprünglichen Blattfläche verlieren können (Gehring et al. 2018a). Zur Bildung von Ersatzkronen mobilisieren die Bäume ihre Reserven und verbrauchen diese dabei weitgehend.
Gegenmaßnahmen und aktuelle Verbreitung
 Zoombild vorhanden
Zoombild vorhanden
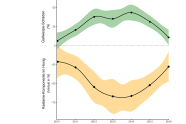
Abb. 3: Entwicklung der durch die Asiatische Edelkastaniengallwespe verursachten Kronenschäden (grün) und Verlust an der Kastanienkomponente des Honigs (orange). (Modifiziert aus Gehring et al. 2018b)
Ausgehend von den japanischen Erfahrungen wurde ab 2005 Torymus sinensis auch in Italien und Frankreich mit sehr großem Erfolg freigesetzt (Quacchia et al. 2008). Im Jahr 2013 ist der Antagonist aus Italien in die Schweiz eingewandert, wo eine beabsichtigte Freilassung bislang aus Gründen der Biosicherheit verboten war. Er hat dort der Edelkastanie eine eindeutige Erholung verschafft (Gehring et al. 2018a). Dies wird auch aus der Analyse der Anteile davon im Kastanienhonig deutlich (Gehring et al. 2018b; Abbildung 3).
Aus der Erfahrung in der Südschweiz wird deutlich, dass die Schwächung der Edelkastanie proportional zu den Gallwespe-Epidemie-Jahren ohne natürlichen Gegner zunimmt. Wo mehr als vier bis fünf Jahre zwischen Ankunft der Edelkastaniengallwespe und des Auftretens ihres Antagonisten verstrichen sind, sind Edelkastanien, die schon von der Sommerdürre 2003 und durch eine Infektion mit Kastanienrindenkrebs geschwächt waren, so angeschlagen, dass sie zum Teil zu Grunde gehen.
 Zoombild vorhanden
Zoombild vorhanden
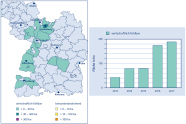
Abb. 4: Aktuelle Schadensmeldungen für die Asiatische Edelkastaniengallwespe in Südwestdeutschland. (Grafik: J. Wußler)
Der Befallsverlauf folgt hier dem Oberrheinischen Tiefland in den zu Schwarzwald, Vogesen (Fredon-Alsace 2017) und Pfälzerwald übergehenden Regionen. An den zum Rheintal gelegenen Rändern dieser Gebirge wurde die Edelkastanie unter anderem im Zusammenhang mit dem Weinbau intensiv kultiviert. Es bestehen aber auch Nachweise für andere Bundesländer wie Nordrhein-Westfalen, Hessen und Thüringen, wo die Edelkastanie weniger häufig vorkommt.
Eine weitere Ausbreitung wird wohl auch in Deutschland nicht aufzuhalten sein (Schumacher 2013). Es ist gut vorstellbar, dass auch hier der Antagonist Torymus sinensis auf natürlichem Wege Einzug halten wird, wie vor allem in der Schweiz geschehen und offenbar auch in Frankreich schon beobachtet (Fleisch et al. 2017). Zumindest in der Schweiz kann es dadurch zu einer Erholung für die Edelkastanie kommen.
Der Kastanienrindenkrebs – eine weltweite Geschichte
In Europa wurde die Krankheit erstmals 1938 im Hinterland des internationalen Hafens von Genua (Italien) entdeckt (Rigling und Prospero 2018). Genetische Analysen zeigten, dass sie aus den USA eingeschleppt wurde. Weitere Einschleppungen aus Asien oder aus den USA fanden in Westfrankreich und im Kaukasus in Georgien statt (Dutech et al. 2012; Prospero et al. 2013). Heutzutage ist der Kastanienrindenkrebs in allen wichtigen Kastaniengebieten Europas vorhanden – von Italien bis Deutschland und nach Portugal, über die Türkei bis zum Kaukasus.
Biologie und Lebenszyklus des Erregerpilzes
Die sexuellen Sporen (Ascosporen) entstehen in den Perithezien durch Interaktion der beiden Kreuzungstypen des Pilzes. Reife Ascosporen werden aktiv ausgeschleudert und vor allem durch den Wind über Distanzen bis zu einigen hundert Metern weit verbreitet. Landen Konidien oder Ascosporen auf frischen Wunden (z. B. Wachstumsrissen) einer Edelkastanie, können sie diesen Baum infizieren. Die Fruchtkörper des Pilzes entwickeln sich nicht nur auf der befallenen Rinde lebender Bäume, sondern auch auf frisch abgestorbener Rinde (z. B. nach einem Waldbrand, auf frisch gefällten Stämmen oder abgeschnittenen Ästen).
Befallssymptome
 Zoombild vorhanden
Zoombild vorhanden
Abb. 5: Symptome und Zeichen des Kastanienrindenkrebses. Hier Bäume mit starkem Krebsbefall in der Krone. (Foto: Phytopathologie, WSL (CH))
Welkende Blätter während der Vegetationsperiode oder braune, hängende Blätter an einzelnen Ästen im Winter sind neben Rindenkrebsen typische Anzeichen eines Befalls durch den Krankheitserreger (Abbildung 6). Unterhalb der Infektionsstelle entstehen zahlreiche Wasserreiser. In der Rinde und im Kambiumbereich bildet [i]Cryphonectria parasitica[/i] typische gelbliche Myzelfächer, mit denen er im Wirtsgewebe vordringt (Abbildung 9). Auf der befallenen Rinde entstehen hingegen die kleinen orangenen Fruchtkörper des Pilzes, in denen sich die Sporen entwickeln (Abbildung 10).
Die Hypovirulenz
Dieses sogenannte [i]Cryphonectria[/i] Hypovirus 1 (CHV-1) wurde vermutlich zusammen mit dem Pathogen aus Asien eingeschleppt. Seine Präsenz verlangsamt nicht nur das Wachstum von [i]C. parasitica[/i] im Rindengewebe der Edelkastanien, sondern reduziert auch die Ausbildung von Konidien und unterbindet die sexuelle Fortpflanzung. Dieses Phänomen wird als Hypovirulenz bezeichnet. CHV-1 kommt nur innerhalb der Pilzzellen vor und kann entweder bei einem direkten Kontakt zweier Pilzindividuen, die zum gleichen vegetativen Kompatibilitätstyp gehören, oder via Konidien (nicht aber über Ascosporen) verbreitet werden.
Die Kontrolle der Krankheit
 Zoombild vorhanden
Zoombild vorhanden
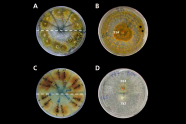
Abb. 11: Kompatibilitätsgruppen für unterschiedliche
Stämme von Cryphonectria parasitica. (Foto: G. Seiffert, FVA)
Eine Beseitigung der Krankheit ist nur am Anfang eines Befalles realistisch, wenn wenige Einzelbäume befallen sind. Zu diesem Zweck müssen befallene Äste zurückgeschnitten oder ganze Bäume gefällt werden. Das kranke Pflanzenmaterial sollte unmittelbar vor Ort verbrannt oder einer Verbrennungsanlage zugeführt werden. Ist die Krankheit in einem Bestand schon weit verbreitet, besteht die Möglichkeit, sie mit dem Virus der Hypovirulenz zu kontrollieren. Im Falle einer natürlichen Etablierung der Hypovirulenz erfolgt diese Kontrolle spontan. Wo eine natürlich auftretende Hypovirulenz fehlt, ist die künstliche Ausbringung des Virus durch die Behandlung virulenter Rindenkrebse mit hypovirulenten [i]C. parasitica[/i]-Stämmen möglich.
Untersuchungen aus Südwestdeutschland konnten zeigen, dass eine fortschreitende Diversifizierung sowohl des Erregers als auch des Virus seit der Einschleppung stattfindet. Die vegetative Kompatibilität einzelner Pilzstämme untereinander (Abbildung 11), also die Möglichkeit, dass Myzelien unterschiedlicher Pilzstämme miteinander verwachsen, sind von entscheidender Bedeutung für erfolgreiche Behandlungsmaßnahmen (Peters et al. 2014).
Die Tintenkrankheit
Die Krankheitsgeschichte
Doch seit den 1990er Jahren scheint die Tintenkrankheit wieder an Bedeutung zu gewinnen, da in verschiedenen europäischen Ländern Edelkastanienbäume mit den typischen Symptomen immer häufiger gemeldet werden. Heutzutage ist die Krankheit vor allem im südlichen Ausbreitungsgebiet der Edelkastanie vorhanden (Spanien, Portugal, Frankreich, Schweiz, Italien, Griechenland, Rumänien, Mazedonien, Türkei). Aber auch nördlichere Länder wie Großbritannien, Tschechien und Polen sind immer häufiger betroffen (Vannini und Vettraino 2001; Černy et al. 2008).
Befallssymptome
An infizierten jungen Bäumen zeigen sich solche Läsionen oberflächlich durch eingesunkene Rindenpartien. Sie sind auch ohne die Rinde zu entfernen sichtbar. Der Name »Tintenkrankheit« nimmt Bezug auf das Phänomen austretender schwarzer Rindenexsudate, welche häufig mit den Läsionen assoziiert sind. Eine Infektion kann innerhalb von zwei bis drei Jahren zum Absterben eines Baumes führen (Černy et al. 2008; Vettraino et al. 2005). Da die Tintenkrankheit das Wurzelsystem schädigt, unterbleibt eine Ausbildung von Stockausschlägen an der Basis befallener Bäume (Abbildung 15).
Biologie und Lebenszyklus der Krankheitserreger
Außerdem können sie auch begeißelte, asexuelle Zoosporen (vergleichbar den Konidien) produzieren, die im Wasser beweglich sind und sich vornehmlich im wässrigen Milieu ausbreiten. Wenn diese Sporen auf Wurzeln einer anfälligen Pflanze treffen, keimen sie aus und starten eine Infektion. Bei für den Erreger ungünstigen Bedingungen kann [i]P. cinnamomi[/i] auch asexuelle, dickwandige Chlamydosporen bilden, welche der Überdauerung (z. B. Trockenperioden) dienen. Beide Arten besitzen ebenfalls zwei Kreuzungstypen. Wenn beide Typen vorhanden sind, kann die sexuelle Fortpflanzung mit der Produktion von sexuellen Oosporen theoretisch auch stattfinden.
Beide Arten sind in Europa nicht heimisch: [i]Phytophthora cinnamomi[/i] stammt vermutlich aus Papua-Neuguinea, während für [i]P. cambivora[/i] die genaue Herkunft noch nicht zweifelsfrei geklärt ist. Beide Arten besitzen ein außergewöhnlich breites Wirtsspektrum. Mit mehr als 4.000 potenziellen Wirtspflanzenarten gilt das besonders für P. cinnamomi und erklärt auch ihr stark erhöhtes Schadpotenzial (Hardman und Blackman 2018). Der wichtigste limitierende Faktor für ein weiter verbreitetes Vorkommen dieser zwei Krankheitserreger in Europa scheint die Temperatur zu sein. Insbesondere [i]P. cinnamomi[/i] ist sehr kälteempfindlich und kommt bisher nicht in Regionen vor, in denen die Minimaltemperaturen unterhalb von 1,4 °C liegen.
Untersuchungen in Baden-Württemberg belegen für den südlichen Oberrhein das Vorkommen für [i]P. cinnamomi[/i] im Zusammenhang mit der Mortalität bei Edelkastanien. Entscheidend für das Vorkommen von [i]P. cinnamomi[/i] in der Rhizosphäre waren vor allem die Niederschlagshöhe und die Bodenfeuchte (Wunderlich 2011).
Regulierungsmaßnahmen und aktuelle Situation
Eine relativ einfache Maßnahme ist, die Bodenentwässerung zu verbessern. Feuchte Böden fördern die Bildung und Ausbreitung der Zoosporen, die sich aktiv im Wasser bewegen können. Vor allem nach starken Regenfällen werden massenweise Sporen gebildet und mit dem Regenwasser flächig verbreitet. Entwässerungsgräben, in denen das Oberflächenwasser abfließen kann, könnten helfen, die Sporenausbreitung zu reduzieren.
Da [i]P. cinnamomi[/i] und [i]P. cambivora[/i] bodenbürtige Pathogene sind, sollte die Verschleppung infizierter Erde (z. B. mittels Schuhe, Werkzeuge oder Fahrzeuge) in noch nicht betroffene Gebiete absolut verhindert werden. Asiatische Kastanienarten sind weniger anfällig gegenüber der Tintenkrankheit. Hybriden aus Kreuzungen dieser Arten mit der Edelkastanie sind auf dem Markt erhältlich und könnten angepflanzt werden.
Schlussbemerkungen
Für die Zukunft ist es deshalb besonders wichtig, dass diese Baumart möglichst unter idealen Standort- und Umweltverhältnissen kultiviert wird. Ideale Wuchsbedingungen minimieren die Auswirkungen krankheitsbedingter Risiken. Durch die Klimaänderung ist nicht auszuschließen, dass heute noch positiv zu bewertende Kastanienwuchsgebiete sich zukünftig hin in Richtung ungünstige Bedingungen für eine Kultivierung dieser Baumart verändern werden. Andererseits können bis dato klimatisch ungünstigere Regionen plötzlich neue, der Edelkastanie zuträgliche Verhältnisse aufweisen.
Empfehlenswert ist es außerdem, Kastanienbäume regelmäßig auf Schädlinge und Pathogene hin zu inspizieren, und falls diese auftreten, das befallene Pflanzenmaterial umgehend zu vernichten. Jungpflanzen sollten nur aus nachweislich infektionsfreien Baumschulen bezogen werden.
Zusammenfassung
Dabei veranschaulichen wir, wie die Edelkastanie bedingt durch ihren Ursprung und aufgrund ihrer Kultivierungsgeschichte sehr anfällig auf diese spezifischen Schädlinge und Krankheiten ist. Für die Zukunft ist es deshalb besonders wichtig, dass diese Baumart möglichst unter idealen Standort- und Umweltverhältnissen kultiviert wird. Ideale Wuchsbedingungen minimieren krankheitsbedingte Risiken und leisten ebenfalls einen entscheidenden Beitrag zur Minimierung der Auswirkungen von allfälligen Schädlingsbefällen für diese Baumart.
Literatur
- Brussino, G.; Bosio, G.; Baudino, M.; Giordano, R.; Ramello, F.; Melika, G. (2002): Pericoloso insetto esotico per il castagno europeo. L’Informatore Agrario. 37: 59–62
- Ćerný, K.; Gregorová, B.; Strnadova, V.; Tomšovský, M.; Holub, V.; Gabrielová S. (2008): Phytophthora cambivora causing ink disease of sweet chestnut recorded in the Czech Republic. Czech Mycology 60: 265–274
- Conedera, M.; Krebs, P. (2008): History, present situation and perspective of chestnut cultivation in Europe. Proceedings of the II Iberian Congress on Chestnut, Vila Real, Portugal. Acta Horticulturae 784: 23–27
- Conedera, M.; Barthold, F.; Torriani, D.; Pezzatti, G. B. (2010): Drought sensitivity of Castanea sativa: case study of summer 2003 in the southern Alps. Acta Hortic. 866, 297–302
- Delb, H.; Grüner, J.; John, R.; Seitz, G.; Wußler, J. (2018a): Waldschutzsituation 2017/2018 in Baden-Württemberg. AFZ-Der Wald, 73 (7), 14–17
- Delb, H.; Grüner, J.; John, R.; Seitz, G.; Wußler, J. (2018b): Waldschutzsituation 2017/2018 in Rheinland-Pfalz und Saarland. AFZ-Der Wald, 73 (7), 22–25
- Dode, L. A. (1908): Sur les châtaigniers. Bull. Soc. Dendr. France, 140–159
- Dutech, C.; Barres, B.; Bridier, J.; Robin, C.; Milgroom, M. G.; Ravigne, V. (2012): The chestnut blight fungus world tour: successive introduction events from diverse origins in an invasive plant fungal pathogen. Mol. Ecol. 21: 3931–3946
- EPPO (European and Mediterranean Plant Protection Organization) (2018): Dryocosmus kuriphilus distribution. https:// gd.eppo.int/taxon/DRYCKU/ (besucht am 19. Februar 2018)
- Fleisch, A.; Thaon, M.; Borowiec, N. (2017): Parasitoïdes associés au cynips du châtaignier en Alsace. Phytoma N° 704 Mai 2017. web: researchgate.net/profile/Nicolas_Borowiec/ publication/320870686_Parasitoides_associes_au_cynips_ du_chataignier_en_Alsace/links/5a003f92aca2726b6cf292d3/ Parasitoides-associes-au-cynips-du-chataignier-en-Alsace.pdf, abgerufen am 22.04.2018
- Fredon-Alsace (2017): Fiche d’information: Le cynips du châtaignier Dryocosmus kuriphilus; web: fredon-alsace, .fr/ wp-content/uploads/2017/03/Fiche_Dryocosmus_kuriphilus. pdf, abgerufen am 22.04.2018
- Gehring, E.; Bellosi, B.; Quacchia, A.; Conedera, M. (2018a): Assessing the impact of Dryocosmus kuriphilus on the chestnut tree: branch architecture matters. Journal of Pest Science, 91(1), 189–202
- Gehring, E.; Kast, C.; Kilchenmann, V.; Bieri, K.; Gehrig, R.; Pezzatti, G.B.; Conedera, M. (2018b): Impact of the Asian chestnut gall wasp, Dryocosmus kuriphilus (Hymenoptera, Cynipidae), on the chestnut component of honey in the southern Swiss Alps. Journal of Economic Entomology, 111(1), 43–52
- Hardman, A. R.; Blackman, L. M. (2018): Phytophthora cinnamomi. Molecular Plant Pathology 19: 260–285
- Lang, P.; Dane, F.; Kubisiak, T. L.; Huang, H. W. (2007): Molecular evidence for an Asian origin and a unique westward migration of species in the genus Castanea via Europe to North America. Molecular Phylogenetics and Evolution, 43 (1), 49–59
- Meyer, J. B.; Gallien, L.; Prospero, S. (2015): Interaction between two invasive organisms on the European chestnut: does the chestnut blight fungus benefit from the presence of the gall wasp? FEMS Microbiology Ecology, 91(11), fiv122 (10 pp.)
- Moriya, S.; Inoue, K.; Ôtake, A.; Shiga, M.; Mabuchi, M. (1989): Decline of the chestnut gall wasp population, Dryocosmus kuriphilus Yasumatsu (Hymenoptera: Cynipidae) after the establishment of Torymus sinensis Kamijo (Hymenoptera: Torymidae). Appl Entomol Zool 24: 231–233
- Peters, F.; Bußkamp, J.; Prospero, S.; Rigling, D.; Metzler, B. (2014): Genetic diversification of the chestnut blight fungus Cryphonectria parasitica and its associated hypovirus in Germany. Fungal Biology 118: 193–210
- Prospero, S.; Lutz, A.; Tavadze, B.; Supatashvili, A.; Rigling, D. (2013): Discovery of a new gene pool and a high genetic diversity of the chestnut blight fungus Cryphonectria parasitica in Caucasian Georgia. Infect. Genet. Evol. 20: 131–139
- Prospero, S.; Vettraino, A. M.; Vannini, A. (2012): Phytophthora on Castanea (Mill.). Julius Kühn Institute Data Sheets, Plant Diseases and Diagnosis. 6, 13 p.
- Quacchia, A.; Moriya, S.; Bosio, G.; Scapin, I.; Alma, A. (2008): Rearing, release and settlement prospect in Italy of Torymus sinensis, the biological control agent of the chestnut gall wasp Dryocosmus kuriphilus. BioControl 53: 829–839
- Rigling, D.; Schütz-Bryner, S.; Heiniger, U.; Prospero, S. (2014): Der Kastanienrindenkrebs. Schadsymptome, Biologie und Gegenmassnahmen. Merkblatt für die Praxis 54: 8 S.
- Rigling, D.; Prospero, S. (2018): Cryphonectria parasitica, the causal agent of chestnut blight: invasion history, population biology and disease control. Mol. Plant Pathol. 19: 7–20
- Schumacher, J. (2013): Japanische Esskastanien-Gallwespe (Dryocosmus kuriphilus YASUMATSU). Waldschutzinfo 1/2013 FVA Baden-Württemberg, 4 S. (http://www.fva-bw.de/publikationen/ wsinfo/wsinfo2013_01.pdf)
- Vannini, A.; Vettraino, A. M. (2001): Ink disease in chestnuts: impact on the European chestnut. Forest Snow and Landscape Research 76: 345–350
- Vettraino, A. M.; Morel, O.; Perlerou, C.; Robin, C.; Diamandis, S.; Vannini A. (2005): Occurrence and distribution of Phytophthora species in European chestnut stands, and their association with Ink disease and crown decline. European Journal of Plant Pathology 111: 169–180
- Wunderlich, L. (2011): Untersuchungen zur Tintenkrankheit (verursacht durch Phytophthora cambivora und Phytophthora cinnamomi) an der Esskastanie (Castanea sativa). Bachelorarbeit. Univ. Freiburg. 55 S.
Beitrag zum Ausdrucken
Weiterführende Informationen
Autoren
- Marco Conedera

- Jörg Grüner
- Horst Delb

- Eric Gehring

- Simone Prospero












