Die Zukunft der Buche – zwischen Rückeroberung und Rücksterben - LWF Wissen 86
Zusammenfassung: Weite Bereich Mitteleuropas liegen vollständig im Buchenareal. Standörtlich hat diese Klimax-Baumart eine große ökologische Amplitude bezüglich Böden und Klima, sofern es nicht zu kontinentalwarm oder zu kalt ist. Allerdings zeigen Schäden in Folge der länger anhaltenden Dürren ab 2018 die Anbaugrenzen unter extremen Bedingungen. Mit Hilfe von Nischenmodellen können die zukünftige klimatische Eignung abgeschätzt und Empfehlungen für den Waldumbau gegeben werden. Auf schwierigen Standorten oder unter einer ungebremsten Erwärmung nimmt die Eignung der Buche deutlich ab. Bei einer milderen Erwärmung und auf besseren Standorten wird diese wichtige Laubbaumart weiterhin eine gewichtige Rolle in Bayern spielen. Um auf einen starken Klimawandel und dessen Dynamik vorbereitet zu sein, sollten jetzt schon klimatolerante Arten eingebracht werden.
Die Buche (Fagus sylvatica L.) ist mit einem Anteil von 16 % an der Waldfläche die häufigste Laubbaumart Deutschlands (BMEL 2016). Die Bedeutung der Buche für den deutschen Wald zeigt sich auch darin, dass deutsche Buchenwälder wie Grumsin, Kellerwald oder Serrahn als UNESCO-Weltnaturerbe geschützt sind (Vološčuk 2014). Umso größer war das Entsetzen in der Öffentlichkeit und bei Waldbesitzenden, als deutliche Schäden an Buchen in der Folge der Trockenjahre ab 2018 sichtbar wurden (BMEL 2021). Dieser Beitrag beleuchtet die Verbreitung, standörtliche Grenzen und Anbaumöglichkeiten sowie Perspektiven der Buche im Klimawandel.
Verbreitung der Buche
Die Gattung Fagus mit ihren insgesamt 10 Arten ist in den ozeanisch geprägten sommerregenreichen Laubwäldern der gemäßigten Breiten verbreitet. Die Heimat der Rotbuche (Fagus sylvatica L.) ist das gemäßigte, subatlantisch bis submediterrane Europa. Ihr Verbreitungsschwerpunkt liegt in Mitteleuropa in der kollinen und der montanen Höhenstufe zwischen 400 und 1400 m. An ihrer Nordgrenze in Südskandinavien wächst sie auf Meereshöhe, im Süden auf Sizilien kommt sie bis in 2250 m Höhe vor. Von West nach Ost erstreckt sich das Buchenareal von Südengland bis in die westliche Ukraine. Vereinzelt lassen sich Vorkommen auch in Kleinasien nachweisen. Die Orient-Buche (Fagus sylvatica ssp. orientalis Lipsky) finden wir darüber hinaus vom Balkan über den Kaukasus bis in den Nord-Iran (siehe Seite 10, Abb. 8 in diesem Band; Areal von Fagus sylvatica und Fagus orientalis)
In ihrer natürlichen Verbreitung ist die Rotbuche meist die dominierende Baumart, obgleich ihre nacheiszeitliche Ausbreitung recht zögerlich verlief. Erst 1000 v. Chr. hatte die Buche ihr heutiges Areal erreicht (Magri 2008). Genetische Untersuchungen deuten darauf hin, dass vor allem Refugien in den östlichen Alpen der Ausgangspunkt für die Besiedlung Mittel- und Nordeuropas waren (Magri et al. 2006). Auch wenn der Mensch sicherlich die Buchenausbreitung beeinflusst hat (Küster 1998), kommen Tinner und Lotter (2006) zum Schluss, dass letztendlich das mildere und feuchtere Klima ausschlaggebend war.
Heute ist die Buche mit 11,9 % Vorratsanteil bzw. 4 Mrd. Vfm die vorratsreichste Laubbaumart Europas (Forest Europe 2020 , geringe Anteile Orientbuche eingeschlossen). In Deutschland lag ihr Vorratsanteil in der Bundeswaldinventur 2012 bei 17,3 % (635 Mio. Vfm) auf 16 % der Waldfläche (1,68 Mio. ha). Sowohl der Flächen- als auch der Vorratsanteil hatten im Vergleich zur Vorinventur um ca. 10.000 ha bzw. 5,8 Mio. Vfm pro Jahr zugenommen. Allerdings stieg auch das Durchschnittsalter der erfassten Buchen auf 100 Jahre und der Starkholzanteil, d. h. der Vorrat der Bäume mit über 50 cm Durchmesser, auf 38 %. Trotz der Schadmengen von 2018 – 2020 in Höhe von 14 Mio. Efm im Laubholz (BMEL 2021) und des kritischen Zustands gerade von Altbuchen (PM Baum des Jahres, 28.10.2021) ist zu erwarten, dass auch die aktuelle vierte Bundeswaldinventur einen weiteren Zuwachs des Buchenanteils feststellen wird.
Ökologische Nische der Buche
Die Erfassung der ökologischen Nische und ihrer Grenzen ist eine Grundvoraussetzung, um das Zukunftspotential der Buche im Klimawandel einzuschätzen (s. u.). Wir nehmen uns daher kurz Zeit für einige wichtige Hinweise zum Konzept der ökologischen Nischen. Die Verbreitung einer Baumart stellt die realisierte Nische dar (sensu stricto Hutchinson 1957). Sie ist geprägt von Klima, Boden, Konkurrenz, Migration und Mensch. Die physiologischen Grenzen (sog. Fundamentalnische, Hutchinson 1957 ) liegen i. d. R. außerhalb der realisierten Nische. Sie bleiben unbekannt, können aber in begrenztem Umfang getestet werden, z. B. durch Anbauversuche (Thurm et al. 2017). Die Methoden zur Herleitung der ökologischen Nische können die Komplexität der auf die Pflanze einwirkenden Faktoren nur vereinfachend wiedergeben. Faktoren können sich gegenseitig ausgleichen oder verstärken. Einzelne Angaben zu den ökologischen Grenzen von Baumarten sind daher nur als grobe Richtwerte zu verstehen.
Schauen wir auf die Buche, so ist deren Verbreitung in Skandinavien durch eine zu kurze Vegetationsperiode begrenzt (mindestens 140 Tage, Magri 2008), wogegen hohe Sommertemperaturen und geringe Niederschläge in der Vegetationsperiode die Vorkommen der Buche im mediterranen Raum begrenzen (Hous tan Durrant 2016; Gazol et al. 2019). An der südlichen Verbreitungsgrenze in Spanien und Sizilien kommt sie nur in höheren Lagen über 1000 m vor (Packham 2012). Im Osten reagiert die Buche empfindlich auf die für das kontinentale Klima üblichen langen, kalten Winter und trockenen Sommer (Bolte und Czajkowski 2007). Buchen sind zwar anfällig gegenüber Spätfrost (Rubio-Cuadrado 2021), können Schäden nach solchen Extrem-Ereignissen aber durch Mobilisierung von Reserven (z. B. Johannistrieb) ausgleichen (D’Andrea 2017). Zusammenfassend leiten Bolte und Czajkowski (2007) folgende Minimumbedingungen ab, die für die Verbreitung der Buche in unterschiedlichen Kombinationen notwendig sind:
- Niederschlagsmenge von 500 mm pro Jahr bzw. 250 mm zwischen Mai und September
- Mittlere Juli-Temperatur von unter 19°C
- Weniger als 141 Frosttage mit einem Tagesminimum unter 0°C
- Mittlere Januartemperatur über –3°C
- Mehr als 271 Tage mit einer mittleren Tagestemperatur von mindestens 7°C
- Keine extreme Hitze oder Dürre, sowie Winterfröste unter –35 °C oder starke Spätfröste
Für den warmtrockenen Rand der Buchenverbreitung wird oft der sog. Ellenberg-Quotient zitiert (Ellenberg 1988, Mellert et al. 2016, Stojanovic 2013, Matyas et al. 2010). Er errechnet sich als Quotient von Juli-Temperatur und Jahresniederschlag. Basierend darauf beziffert Ellenberg (1988) einen Wert von 30 als Grenzwert zwischen Buchen- und Eichenwäldern. Die Bundeswaldinventur zeigt allerdings, dass schon ab einem Wert von 25 die Eichenwälder dominieren (Dolos et al. 2016). Vielfach wurde die Buche im Mittelalter zugunsten von Nieder- und Mittelwäldern mit stockausschlagfähigen Arten wie der Eiche zurückgedrängt (LWF, 2014). Selbst in Regionen mit jahrhundertealter Eichentradition wie dem Spessart oder auf der Fränkischen Platte würden natürlicherweise Buchenwälder vorherrschen, wie die Naturwaldforschung belegt (Blaschke et al. 2021, Röder et al. 2021). Auch für Ungarn und die Karpaten stellt der Ellenberg-Quotient eine gute Näherung für die Wärme-Trockengrenze der Buchen dar (Czúcz et al. 2011, Hohnwald et al. 2020).
Allgemein werden Buchen gegenüber sommerlichen Niederschlagsausfällen als mäßig sensitiv beschrieben (Leuschner 2020). Die Art reguliert die Spaltöffnungen (Stomata) ihrer Blätter anisohydrisch (Leuschner 2022), d. h. auch bei Trockenstress bleiben die Stomata lange geöffnet. So hält die Buche die Photosynthese aufrecht, läuft aber Gefahr, dass der Wasserstrom in den Leitungsbahnen abreißt und Embolien entstehen. Um dies zu vermeiden, sind kontinuierliche Niederschläge in der Vegetationsperiode wichtig (Leuschner 2020). Kommt es im Zuge von Dürren verstärkt zu Embolien im Wasserleitungsgewebe, so kann dies zu partiellem Kronenverlust und ultimativ dem Absterben des Baums führen (Walthert et al. 2021, Arend et al. 2022). Buchen der warmtrockenen Verbreitungsgrenze zeigen dabei eine höhere Dürre-Resistenz (Muffler et al. 2020), was u. a. mit der Anpassung morphologischer und physiologischer Blattmerkmale erklärt werden kann (Weit mann et al. 2021). Aber nicht nur die Herkunft ist von großer Wichtigkeit – auch in ein und demselben Bestand konnten Pfenniger et al. (2021) genetische Unterschiede entdecken, die erklären, wie gut eine Buche Dürren widerstehen und sich nach Dürren zu erholen vermag. In gewissem Umfang kann auch die Bewirtschaftung von Buchenbeständen die Dürre-Resistenz beeinflussen. So sind Buchen in Mischbeständen (Chakraborty et al. 2017) oder aus langfristig unbewirtschafteten Beständen (Mausolf et al. 2020) weniger sensitiv gegenüber Dürren, auch wenn die Mortalität unterdrückter Individuen in Extremjahren durchaus steigen kann (Meyer et al. 2022). An geschützten Standorten oder bei hoher Bodenwasserspeicherkapazität kann Buche auch in klimatisch ungeeigneten Klimaregionen gedeihen (Mellert et al. 2018), schwere Böden können Trockenheitseffekte eher verstärken (Obladen et al. 2021).
Interessant ist die Rolle der Buche hinsichtlich Dürretoleranz von Mischungen von Buche und Nadelholz. Thurm et al. (2016) fanden heraus, dass sich Douglasien in Buchen-Mischbeständen schneller von Dürren erholen als in Reinbeständen. Ausschlaggebend war, dass die immergrüne Douglasie schon vor dem Blattaustrieb der Buche die Bodenwasservorräte für ihre Photosynthese nutzen kann. Rukh et al. (2020) kommen zu einem ähnlichen Ergebnis für Buchen-Fichten-Bestände. Hier profitiert die Fichte als Flachwurzler auch, weil die Buche mit ihren tieferen Wurzeln Wasser aus tieferen in höhere Bodenschichten zieht.
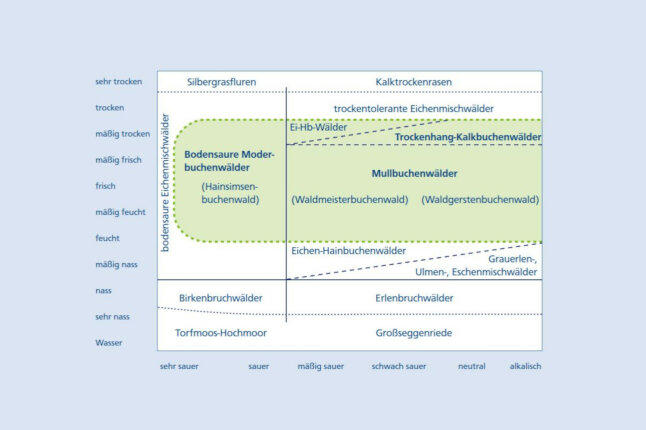
Abb. 1: Ökogramm nach Ellenberg und Leuschner (2010). Fett gestrichelte Linie sind der Bereich der Buchenwälder. (© LWF)
Wie das Ökogramm zeigt (Abb. 1), wächst die Buche auf einem breiten Spektrum an Böden. PH-Werte von 3,5 bis 8,5 werden toleriert und nur extrem saure Böden gemieden. Nach Ellenberg (1988) werden die Buchenvegetationsgesellschaften der kollinen bis submontanen Höhenstufe in Abhängigkeit vom Boden in drei Verbände gegliedert: die bodensauren Moderbuchenwälder mit dem bekannten Hainsimsenbuchenwald (Luzulo-Fagetum), die nährstoffreicheren Mullbuchenwäldern mit Waldgersten- und Waldmeisterbuchenwald (Hordelymo- und Galioodorati-Fagetum) und die Trockenhang-Kalkbuchenwälder mit Seggen- und Blaugras-Hangbuchenwald (Carici- und Seslerio-Fagetum). Ihr Optimum findet die Buche auf gut nährstoffversorgten und durchlässigen Böden über kalkhaltigen oder vulkanischen Grundgesteinen (Houston Durrant 2016). Überflutungs- und Moorstandorte sowie starker Grund- und Stauwassereinfluss werden nicht toleriert (Packham et al. 2012) oder führen zu flach ausgebildeten Wurzelsystemen, was die Stabilität gegenüber Windwurf reduziert. Die Buchenstreu bildet die Grundlage für eine günstige Humusform, jedoch ist das C:N-Verhältnis relativ hoch im Vergleich zu anderen Laubbaumarten, und darüber hinaus zersetzt sich die Streu schwieriger (Jacob et al. 2010). Auf basen- und kalkarmen Standorten kann es sogar zur Rohhumusbildung kommen, so dass Mayer (1992) den Begriff »Mutter des Waldes« nicht immer zutreffend findet. Nährelementanalysen von Buchenblättern, sog. Blattspiegelwerte, weisen auf eine überwiegend gute Ernährung der Buche in Bayern hin. Kalzium- und Magnesiumernährung sind auf Böden mit entsprechend geringer Ausstattung wie im Grundgebirge zwar niedriger, richtige Mängel gibt es eher bei der Phosphor- und teils bei der Kaliumernährung beispielsweise auf Humusdolomit- bzw. Humuscarbonatböden oder Kalkverwitterungslehmen (Stetter 2015).
Ein weiterer sehr wichtiger Aspekt der Buche ist ihr Umgang mit Licht im Bestand. Die Buche zeichnet sich durch eine sehr hohe Schattentoleranz aus, sodass Sämlinge unter dem Schutz von Buchenaltkronen noch bei sehr geringen Strahlungswerten von 3 % der Strahlung oberhalb des Kronendaches gedeihen (Emborg 1998) und eine positive Kohlenstoffbilanz erzielen können. Sogenannte Schatten ertragende Klimax-Baumarten, zu denen die Buche zählt, zeichnen sich durch besondere morphologische Anpassungen aus: Die Buche hat in der Sonnenkrone eine hohe Blattflächendichte, so dass wenig Licht nach unten durchdringt. Dieses wenige Licht wird dann von speziellen Schattenblättern absorbiert, die sehr dünn, fast horizontal ausgerichtet sind und eine hohe spezifische Blattfläche besitzen (Ellenberg und Leuschner 2010). Diese Eigenschaft macht sie gegenüber anderen Arten wie Eichen (Quercus spec.) sehr konkurrenzstark (Houston Durrant 2016) und führt in Klimax-Wäldern zu Vergesellschaftung mit der ebenso schattentoleranten Weißtanne (Abies alba Mill.). Außerdem erzeugt dieses dichte Kronendach ein feuchteres und kühleres Waldinnenklima, das die Buche bevorzugt. Wird dieses Mikroklima durch Störungen und Schadereignisse deutlich verändert hin zu trockenen und warmen Bedingungen, kann in Verbindung mit Licht ein Wechsel hin zu Eichenwaldgesellschaften erfolgen (Hohnwald et al. 2020).
Die Buche im Klimawandel
Um das Zukunftspotential der Buche im Klimawandel einzuschätzen, greifen wir auf die gerade diskutierte ökologische Nische zurück. Wir bedienen uns dazu Methoden der sog. Artverbreitungsmodellierung, englisch kurz SDM (species distribution modelling), und stellen einen statistischen Zusammenhang zwischen Buchenvorkommen und Klima her. Diese Modelle haben eine lange Historie an der LWF (Brandl et al. 2021, Thurm et al. 2018, Walentowski et al. 2017, Falk und Hempelmann 2013), und sind der Ausgangspunkt für eine Reihe von Praxishilfsmitteln – angefangen bei den Klimahüllen (Kölling 2007) über die Klimarisikokarten (Kölling et al. 2009) bis hin zu den Anbaurisikokarten im Bayerischen Standortinformationssystem (Falk et al. 2013). Andere Ansätze untersuchen den Zusammenhang von Leistung (Brandl et al. 2014), Vitalität (Mette & Falk 2020) oder multipler Kriterien (Albrecht et al. 2021) einer Baumart und den Standortbedingungen. Fischer et al. (2019) modellieren aus der aktuellen eine zukünftige potentiell natürliche Vegetation (zpnV). Allen diesen Ansätzen gemeinsam ist, dass sie aus dem derzeit zu beobachtenden Vorkommen oder dem Wachstum bzw. der Vitalität zu Umweltgrößen einen Zusammenhang ableiten. Unter der Annahme, dass sich dieser Zusammenhang nicht ändert, können modellbasierte Vorhersagen für die Zukunft getroffen werden.
Im Rahmen eines Projekts zum Anbaurisiko im digitalen Bayerischen Standortinformationssystem BaSIS werden derzeit die dem Anbaurisiko zugrunde liegenden Klimaszenarien und Artverbreitungsmodelle von 32 Baumarten aktualisiert. Einer der Gründe für das Projekt war, dass unter dem Eindruck der Dürreschäden von 2018 und der Folgejahre es als dringend notwendig angesehen wurde, auch härtere Klimawandel-Szenarien in Betracht zu ziehen. Selbst wenn die endgültigen Ergebnisse noch nicht vorliegen, zeigt der aktuelle Stand der Artverbreitungsmodelle eine klare Richtung auf. Für die Buche sind die Ergebnisse in Abbildung 2 dargestellt. Die Skala repräsentiert die Vorkommenswahrscheinlichkeit, genau genommen, die »Wahrscheinlichkeit, eine Buche an einem Inventurpunkt anzutreffen«, wobei die maximale Vorkommenswahrscheinlichkeit auf 100 % gesetzt wird. Diese Vorkommenswahrscheinlichkeit spiegelt die lokale Anbauerfahrung mit der Baumart wider, und Daten zeigen, dass ein abnehmendes Vorkommen mit höherer Ausfallwahrscheinlichkeit und sinkenden Anteilen am Bestandesaufbau einhergeht. Es ist daher folgerichtig, wenn das bayerische Standortinformationssystem aus der modellierten Vorkommenswahrscheinlichkeit ein Anbaurisiko ableitet, und für Baumarten mit höherem Risiko geringere Anteile am Bestandesaufbau empfiehlt.
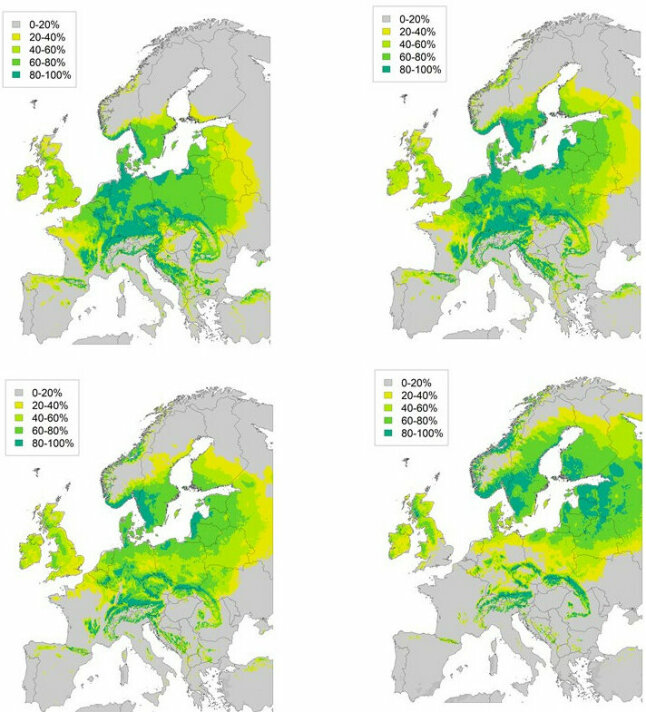
Abb. 2: Klimatische Eignung der Buche mit Hilfe eines Verbreitungsmodels: Für das Klima 1981– 2010, 2071– 2100 (RCP 2.6, 4.5 und 8.5). Die Vorkommensdaten wurden einem Datensatz mit europäischen Inventuren entnommen (Mauri et al. 2017), die Klimadaten entstammen dem Datensatz CHELSA (Karger et al. 2017). (© LWF)
Betrachten wir zunächst das Artverbreitungsmodell der Buche für den Zeitraum 1981 – 2010 (Abb. 2a, links oben). Die Bereiche in Deutschland mit der geringsten Vorkommenswahrscheinlichkeit von 40 – 60 % liegt am Oberrhein. Hier ist die Buche i. d. R. nicht die dominante Baumart und die Art verzeichnete in den Dürrejahren 2018 bis 2020 große Ausfälle. Ansonsten präsentiert sich fast ganz Deutschland als Buchenland mit Vorkommenswahrscheinlichkeiten über 60 %, in Nordwest- und Süddeutschland sogar über 80 %. Wie Abbildung 2b (rechts oben) zeigt, sinkt die Vorkommenswahrscheinlichkeit in der Modellrechnung für das extrem milde Klimawandelszenario (RCP 2.6, Zeitraum 2071 – 2100) lediglich am Oberrhein auf 20 – 40 %, und im nordostdeutschen Tiefland auf 40 – 60 %. Bei dem Klimawandelszenario des RCP 4.5 (Abb. 2c, links unten) ändert sich das Bild. Die Vorkommenswahrscheinlichkeit fällt auf größerer Fläche um 20 %. Die geringsten Werte finden sich am Oberrhein (0 – 20 %), gefolgt vom südlichen nordostdeutschen Tiefland (20 – 40 %), sowie auch von den Tieflagen in Bayern am Untermain und Teilen der Donauniederung. Bei einem extrem starken Klimawandel (RCP 8.5, Abb. 2d, rechts unten) sind die Auswirkungen drastisch. Das Buchenoptimum verschiebt sich nach Skandinavien und ins Baltikum. In Deutschland genügen nur noch die Hochlagen der Mittelgebirge sowie die Alpen den klimatischen Ansprüchen der Buche.
Nicht gekannte Extreme und klimadynamischer Waldbau
Das Jahr 2018 brachte Deutschland einen so nicht gekannten Extremsommer mit hohen Temperaturen und geringen Niederschlägen (Tabelle 1). Fielen im Frühjahr noch 75 % des langjährigen Niederschlagsmittel 1981 – 2010, waren es im Sommer 2018 nur 54 %. Auch die Folgejahre 2019 bzw. 2020 waren im Sommer bzw. Frühjahr ungewöhnlich trocken. Die Buche reagierte auf die Trockenheit mit einem Anstieg der Bäume mit deutlicher Kronenverlichtung von 39 % 2018 auf 47 % 2019 (BMEL 2019). Solche Werte wurden seit 2004 schon öfters erreicht, allerdings stieg die Absterberate auf 0,3 %, drei bis fünf Mal höher als in den letzten 25 Jahren. Die wirklichen Schäden dürften noch wesentlich höher liegen, da in der Waldzustandserhebung nur stehende lebende und tote Bäume angesprochen werden und schwer geschädigte oder tote Bäume, die entfernt wurden, nicht in die Auswertung einfließen. Die Übergänge von reversiblen Schäden wie früher Blattabwurf zu irreversiblem Kronenverlust bis zum Absterben des gesamten Baums sind fließend (Walthert et al. 2021) und hängen davon ab, wie stark das Leitungsgewebe durch Embolien beeinträchtigt wird (Arend et al. 2022). Im Gegensatz zur Fichte oder Kiefer, wo der Borkenkäfer oder das Diplodia-Triebsterben den Baum zum Absterben bringen, sind bei der Buche zunächst weniger Schädlinge als vielmehr die Dürre selbst für den Tod des Baums verantwortlich (vgl. auch Mette und Falk 2020). Zeitversetzt gewinnen Sekundärschädlinge an Bedeutung (Triebenbacher et al. 2022).
Tabelle 1: Saisonale und jährliche Niederschlagssummen gemittelt über in Bayern für den Zeitraum 1981 – 2010 und die Jahre 2018 – 2020 (Daten: DWD-Niederschlagsraster).| Zeitraum | Frühjahr (März - Mai) | Sommer (Juni - August) | Jahr |
|---|
| 1981 - 2010 | 187 mm | 240 mm | 818 mm |
| 2018 | 141 nn | 129 mm | 586 mm |
| 2019 | 183 mm | 175 mm | 735 mm |
| 2020 | 106 mm | 228 mm | 705 mm |
Wie wir Menschen auch, bekommen Bäume den Klimawandel über die Zunahme von Witterungsextremen wie Hitze, Trockenheit oder Starkniederschläge zu spüren und nicht über eine Änderung langjähriger Mittelwerte. Dabei nimmt mit der Änderung langjähriger Mittel auch die Wahrscheinlichkeit für das Auftreten von Extremen zu. D. h. Sommer wie 2018 werden in Zukunft häufiger, auch wenn nicht vorhergesagt werden kann, wann sie das nächste Mal auftreten werden. Es ist daher wichtig, Anpassungsstrategien konsequent umzusetzen. Ansonsten akkumuliert sich eine klimatische »Schuld«, wie es in der Klimafolgenforschung genannt wird (Johnstone et al. 2016, Lenoir et al. 2015, Tal luto et al. 2017). Diese Schuld kann sich bei Extremen schlagartig entladen und führt im Falle von Wald zum Verlust für uns Menschen wichtiger Schutzfunktionen.
Aktuelle Studien an der LWF haben zu neuen Erkenntnissen geführt, die seit 2020 verstärkt in die Praxis eingebracht und gemeinsam diskutiert werden. Eine wesentliche Erkenntnis ist, dass wir dem notwendigen Waldumbau im Klimawandel nur bedingt gerecht werden, wenn wir ein bestimmtes Fernziel an einem bestimmten Zeitpunkt in der Zukunft unter Annahme eines bestimmten Klimawandelszenarios ansteuern. Stattdessen setzt sich immer stärker die Ansicht durch, dass der Waldbau dynamisch auf das Klima reagieren muss (Brandl et al. 2021, Mette et al. 2021). Das heißt, auf die waldbauliche Ausgangssituation eingehen, das Wachstumspotential von Arten mit mittelfristig stabiler Klimaperspektive berücksichtigen, und den Bestand durch Förderung von längerfristig klimatoleranten Arten sichern (Rothkegel et al., dieser Band S. 15 – 22). Die Mischung ist also eine der wichtigsten Strategien für den Waldbau im Klimawandel – aber nicht irgendeine Mischung, sondern eine Mischung, die aktiv längerfristig klimatolerante Arten beteiligt. Zeitgleich werden Praxisanbauversuche zu sog. alternativen Arten in Bayern aktiv gefördert (StMELF 2021). Ziel ist es, Erfahrung zu gewinnen im Anbau von Arten, mit denen wir bisher wenig Erfahrung haben, denen eine wachsende Bedeutung in der Zukunftssicherung unserer Wälder zukommen kann, z. B. Edelkastanie, Zerreiche, Flaumeiche, Schwarzkiefer oder Atlaszeder.
Ausblick – Schlussfolgerungen
Die Buche ist bei den derzeitigen Bedingungen auf zahlreichen Standorten Mitteleuropas eine konkurrenzstarke Klimax-Baumart. Aufgrund ihrer enormen Schattentoleranz kann sie andere, lichtbedürftige Arten wie Eichen verdrängen. Grenzen ihrer Verbreitung liegen klimatisch im Kontinentalen und in der Höhenverbreitung bzw. Ausbreitung in Nordeuropa. Die Extreme seit 2018 haben gezeigt, dass auch die Buche eine Toleranzgrenze hat, die einem starken Klimawandel nicht gewachsen ist. Schadflächen bleiben weiterhin Buchenbestände, eine Anpassungsschuld an die gestiegenen Temperaturen ist aber erkennbar, so dass auf edaphisch schwierigen Standorten (geringer Bodenspeicher für Niederschläge, hoher Tongehalt, Südexposition) ein aktiver Umbau wichtig wäre, um den Schäden durch Überschreiten klimatischer Kipppunkte im Bestandes-Innenklima nicht hinterher zu laufen. Genetische Anpassungen erfolgen im Rahmen einer Naturverjüngung zunächst langsam, sollten aber möglichst zugelassen und mit weiteren Arten angereichert werden. Auf besseren Standorten (Wasser, Exposition, Nährstoffe) bleibt die Buche eine Option, die sinnvoll mit Arten gemischt werden kann, die eine bessere Perspektive im Klimawandel haben. Bei einem milden Klimawandel blieben Deutschland und Bayern Buchenland.
Summary:
Large areas of Central Europe lie entirely within the beech distribution range. This climax tree species has a large ecological amplitude in terms of soils and climate, provided it is not too continental-warm or too cold. However, damage as a result of prolonged droughts from 2018 on shows the limits of cultivation under extreme conditions. Niche models can be used to estimate future climatic suitability and make recommendations for forest conversion. On difficult sites or under unmitigated warming, beech suitability decreases significantly. Under milder warming and on better sites, this important deciduous tree species will continue to play an important role in Bavaria. In order to be prepared for a strong climate change and its dynamics, climate-tolerant species should be introduced now.
Literatur
- Albrecht, A., Kohnle, U., & Michiels, H. G. Klimadynamische Baumarteneignungskarten 2.0 in Baden-Württemberg. In: DVFFA – Sektion Ertragskunde Beiträge zur Jahrestagung 2021, S. 111-127.
- Arend, M., Link, R.M., Zahnd, C., Hoch, G., Schuldt, B., Kahmen, A. (2022): Lack of hydraulic recovery as a cause of post-drought foliage reduction and canopy decline in European beech. New Phytologist 234: 1195-1205
- Bayerisches Staatsministerium für Ernährung, Landwirtschaft und Forsten (StMELF) (2021): BAUMARTEN FÜR DEN KLIMAWALD, Leitlinien der Bayerischen Forstverwaltung. 16 S.
https://www.stmelf.bayern.de/mam/cms01/wald/waldbesitzer_portal/dateien/baumartenwahl_klimawald_zukunft_barrierefrei.pdf, aufgerufen am 20.05.2022
- Blaschke, M., Wahl, W., Förster, B. (2021). Waldstrukturen im Vergleich – Naturwaldreservat und Buchenurwald. LWF aktuell 133, 21-23
- Bolte, A., Czajkowski, T., & Kompa, T. (2007): The north-eastern distribution range of European beech—a review. Forestry, 80(4), 413-429.
- Brandl, S., Mette, T. (2021). ANALOG – Waldzukunft zum Anfassen. LWF aktuell 23, 42-45
- Brandl, S., Falk, W., Klemmt, H. J., Stricker, G., Bender, A., Rötzer, T., & Pretzsch, H. (2014). Possibilities and limitations of spatially explicit site index modelling for spruce based on National Forest Inventory data and digital maps of soil and climate in Bavaria (SE Germany). Forests, 5(11), 2626-2646.
- Bundesministerium für Ernährung und Landwirtschaft (BMEL) (2019): Ergebnisse der Waldzustandserhebung 2019. https://www.bmel.de/SharedDocs/Downloads/DE/Broschueren/ergebnisse-waldzustandserhebung-2019.pdf?__blob=publicationFile&v=4, aufgerufen am 20.05.2022
- Bundesministerium für Ernährung und Landwirtschaft (BMEL) (2021): Waldbericht der Bundesregierung 2021. https://www.bmel.de/SharedDocs/Downloads/DE/Broschueren/waldbericht2021.pdf?__blob=publicationFile&v=11 aufgerufen am 01.04.2022
- Caudullo, G., Welk, E., San-Miguel-Ayanz, J. (2017): Chorological maps for the main European woody species. Data in Brief 12, 662-666. DOI: 10.1016/j.dib.2017.05.007
- Chakraborty, T., Saha, S., Matzarakis, A., & Reif, A. (2017). Influence of multiple biotic and abiotic factors on the crown die-back of European beech trees at their drought limit. Flora, 229, 58-70.
- Czúcz, B., Gálhidy, L., Mátyás, C., 2011. Present and forecasted xeric climatic limits of beech and sessile oak distribution at low altitudes in Central Europe. Ann. For. Sci. 68, 99–108. http://dx.doi.org/10.1007/s13595-011-0011-4
- D’Andrea, E., Rezaie, N., Battistelli, A., Gavrichkova, O., Kuhlmann, I., Matteucci, G., Moscatello, S., Proietti, S., Scartazza, A., Trumbore, S., Muhr, J. (2019): Winter’s bite: beech trees survive complete defoliation due to spring late-frost damage by mobilizing old C-reserves. New Phytologist 224(2): 625-631.
- Dolos, K., Mette, T., & Wellstein, C. (2016). Silvicultural climatic turning point for European beech and sessile oak in Western Europe derived from national forest inventories. Forest Ecology and Management, 373, 128-137.
- Ellenberg, H. (1988): Vegetation ecology of Central Europe, 1st edn. Cambridge University Press, Cambridge, 731 p.
- Ellenberg, H., & Leuschner, C. (2010). Vegetation Mitteleuropas mit den Alpen: in ökologischer, dynamischer und historischer Sicht (Vol. 8104). Utb.
- Emborg, J. (1998): Understorey light conditions and regeneration with respect to the structural dynamics of a near-natural temperate deciduous forest in Denmark. Forest Ecology and Management 106: 83-95.
- Falk, W., Hempelmann, N. (2013). Species favourability shift in europe due to climate change: a case study for Fagus sylvatica L. and Picea abies (L.) Karst. based on an ensemble of climate models. Journal of Climatology, 2013.
- Falk, W., Mellert, K.-H., Bachmann-Gigl, U., Kölling, C., (2013). Bäume für die Zukunft: Baumartenwahl auf wissenschaftlicher Grundlage. LWF-aktuell 94, 8-11
- Fischer, H. S., Michler, B., & Fischer, A. (2019). High resolution predictive modelling of potential natural vegetation under recent site conditions and future climate scenarios: Case study Bavaria. Tuexenia, 39, 9-40.
- FOREST EUROPE, 2020: State of Europe’s Forests 2020.
- Gazol, A., Camarero, J.J., Colangelo, M., de Luis, M., del Castillo, E.M., Serra-Maluquer, X. (2019): Summer drought and spring frost, but not their interaction, constrain European beech and Silver fir growth in their southern distribution limits. Agricultural and Forest Meteorology 278: 107695.
- Hohnwald, S., Indreica, A., Walentowski, H., & Leuschner, C. (2020). Microclimatic Tipping Points at the Beech–Oak Ecotone in the Western Romanian Carpathians. Forests, 11(9), 919.
- Houston Durrant, T., de Rigo, D., Caudullo, G. (2016): Fagus sylvatica and other beeches in Europe: distribution, habitat, usage and threats. In: In: San-Miguel-Ayanz, J., de Rigo, D., Caudullo, G., Houston Durrant, T., Mauri, A. (Eds.), European Atlas of Forest Tree Species. Publ. Off. EU, Luxembourg, pp. e012b90+.
- Hutchinson, G.E. (1957): Concluding remarks. Cold Spring Harb Sym 22: 415–427.
- Jacob, M., Viedenz, K., Polle, A., & Thomas, F. M. (2010). Leaf litter decomposition in temperate deciduous forest stands with a decreasing fraction of beech (Fagus sylvatica). Oecologia, 164(4), 1083-1094.
- Johnstone, J.F.; Allen, C.D.; Franklin, J.F.; Frelich, L.; Harvey, B.J.; Higuera, P.; Mack, M.C.; Meentemeyer, R.; Metz, M.R.; Perry, G.L.; et al. Changing disturbance regimes, ecological memory, and forest resilience. Front. Ecol. Environ. 2016, 14, 369–378.
- Kölling, C. (2007). Klimahüllen für 27 Baumarten. AFZ/ Der Wald, 23, 1242-1245
- Kölling, C., Dietz, E., Falk, W., Mellert K.-H. (2009). Provisorische Klima-Risikokarten als Planungshilfen für den klimagerechten Waldumbau in Bayern. LWF Wissen 63, 31-39.
- Küster, H. (1998): Geschichte des Waldes, C.H. Beck, München, 267 S.
- Lenoir, J.; Svenning, J.-C. Climate-related range shifts—A global multidimensional synthesis and new research directions. Ecography 2015, 38, 15–28
- Leuschner, C. (2020): Drought response of European beech (Fagus sylvatica L.) – A review. Perspectives in Plant Ecology, Evolution and Systematics 47: 125576.
- LWF, 2014. Beiträge zur Traubeneiche. LWF Wissen, Freising, Germany.
- Magri, D., Vendramin, G.G., Comps, B., Dupanloup, I., Geburek, T., Gömöry, D., Latalowa, M., Litt, T., Paule, L., Roure, J.M., Tantau, I., van der Knaap, W.O., Petit, R.J., de Beaulieu, J.-L. (2006): A new scenario for the Quaternary history of European beech populations: palaeobotanical evidence and genetic consequences. New Phytologist 171: 199-221.
- Magri, D. (2008): Patterns of post-glacial spread and the extent of glacial refugia of European beech (Fagus sylvatica). Journal of Biogeography 34, 450.
- Mátyás, C., Berki, I., Czúcz, B., Gálos, B., Móricz, N., & Rasztovits, E. (2010). Future of beech in Southeast Europe from the perspective of evolutionary ecology. Acta Silvatica et Lignaria Hungarica, 6, 91-110.
- Mausolf, K., Härdtle, W., Hertel, D., Leuschner, C., Fichtner, A. (2020): Impacts of multiple environmental change drivers on growth of European beech (Fagus sylvatica): Forest history matters. Ecosystems 23: 529-540.
- Mayer, H., (1992) Waldbau auf sozio-ökologischer Grundlage. Spektrum Akademischer Verlag; 4. Edition, 522 S.
- Mellert, K. H., Ewald, J., Hornstein, D., Dorado-Liñán, I., Jantsch, M., Taeger, S., Zang, C., Menzel, A. & Kölling, C. (2016). Climatic marginality: a new metric for the susceptibility of tree species to warming exemplified by Fagus sylvatica (L.) and Ellenberg’s quotient. European journal of forest research, 135(1), 137-152.
- Mellert, K. H., Lenoir, J., Winter, S., Kölling, C., Čarni, A., Dorado-Liñán, I., ... & Ewald, J. (2018). Soil water storage appears to compensate for climatic aridity at the xeric margin of European tree species distribution. European Journal of Forest Research, 137(1): 79-92.
- Mette, T., Brandl, S., & Kölling, C. (2021). Climate Analogues for Temperate European Forests to Raise Silvicultural Evidence Using Twin Regions. Sustainability, 13(12), 6522.
- Mette, T., & Falk, W. (2020) Extreme Trockenheit–wie sie auf Vitalität und Anbaurisiko von Waldbäumen wirkt. LWF aktuell 3/2020, S. 30-34.
- Muffler, L., Weigel, R., Hacket-Pain, A.J., Klisz, M., van der Maaten, E., Wilmking, M., Kreyling, J., van der Maaten-Theunissen, M. (2019): Lowest drought sensitivity and decreasing growth synchrony towards the dry distribution margin of European beech. Journal of Biogeography 47(9): 1910-1921.
- Obladen, N., Dechering, P., Skiadaresis, G., Tegel, W., Keßler, J., Höllerl, S., Kaps, S., Hertel, M., Dulamsuren, C., Seifert, T., Hirsch, M., Seim, A. (2018): Tree mortality of European beech and Norway spruce induced by 2018-2019 hot droughts in central Germany. Agricultural and Forest Meteorology, 307: 108482.
- Packham, J.R., Thomas, P., Atkinson, M.D., Degen, T. (2012): Biological Flora of the Briskish Isles: Fagus sylvatica. Journal of Ecology 100: 1557-1608.
- Pfenniger, M., Reuss, F., Kiebler, A., Schönnenbeck, P., Caliendo, C., Gerber, S., Cocchiararo, B., Reuter, S., Blüthgen, N., Mody, K., Mishra, B., Bálint, M., Thines, M., Feldmeyer (2021): Genomic basis for drought resistance in European beech forests threatened by climate change. eLife 10: e65532.
- Röder, M., Kudernatsch T., Blaschke, M. (2021). Vom artenreichen Mittelwald zum »sekundären Urwald. LWF aktuell 131, 37-39
- Rubio-Cuadrado, A., Gómez, C., Rodriguez-Calcerrada, J., Perea, R., Gordaliza, G.G., Camarero, J.J., Montes, Gil, L. (2021): Differential response of oak and beech to late frost damage: an integrated analysis from organ to forest. Agricultural and Forest Meteorology 297: 108243.
- Rukh, S., Poschenrieder, W., Heym, M., Pretzsch, H. (2020): Drought Resistance of Norway Spruce (Picea abies [L.] Karst) and European Beech (Fagus sylvatica [L.]) in Mixed vs. Monospecific Stands and on Dry vs. Wet Sites. From Evidence at the Tree Level to Relevance at the Stand Level. Forests 11(16): 639.
- Stetter, U. (2015) Waldernährung in Bayern - Ergebnisse der BZE II. In: Waldböden in Bayern. Forstlicher Forschungsbericht München 213, 59 – 84.
- Stojanovic´, D.B., Krzˇicˇ, A., Matovic´, B., Orlovic´, S., Duputie, A., Djurdjevic´, V., Galic´, Z., Stojnic´, S., 2013. Prediction of the European beech (Fagus sylvatica L.) xeric limit using a regional climate model: an example from southeast Europe. Agric. For. Meteorol. 176, 94–103. http://dx.doi.org/10.1016/j.agrformet.2013.03.009
- Talluto, M.V.; Boulangeat, I.; Vissault, S.; Thuiller, W.; Gravel, D. Extinction debt and colonization credit delay range shifts of eastern North American trees. Nat. Ecol. Evol. 2017, 1, 637. [Cro
- Tinner, W. & Lotter, A.F. (2006): Holocene expansions of Fagus sylvatica and Abies alba in Central Europe: where are we after eight decades of debate? Quaternary Science Reviews 25(5-6): 526-549.
- Thurm, E.A. & Pretzsch, H. (2016): Improved productivity and modified tree morphology of mixed versus pure stands of European beech (Fagus sylvatica) and Douglas-fir (Pseudotsuga menziesii) with increasing precipitation and age. Annals of Forest Science 73: 1047-1061.
- Thurm, E.A., Mette, T., Huber, G., Uhl, E., Falk, W. (2017): Anbauempfehlungen – von der Forschung in die Fläche. AFZ-DerWald 22: 19-23.
- Thurm, E. A., Hernandez, L., Baltensweiler, A., Ayan, S., Rasztovits, E., Bielak, K., ... & Falk, W. (2018). Alternative tree species under climate warming in managed European forests. Forest Ecology and Management, 430, 485-497.
- Triebenbacher, C.; Bork, K.; Burgdorf, N.; Haas, J.; Lemme, H.; Lobinger, G.; Straßer, L.; Hahn, A. (2022): Beim Borkenkäfer wachsam bleiben. BLW 17, S. 24 – 26.
- Vološčuk, I. (2014): Joint Slovak-Ukraine-Germany Beech Ecosystems as the World Natural Heritage. Ekológia Bratislava 33(3): 286-300.
- Weitmann, G., Schuldt, B., Link, R.M., Heil, D., Hoeber, S., John, H., Müller-Haubold, H., Schüller, L.-M., Schumann, K., Leuschner, C. (2021): Leaf trait modification in Euroipean beech trees in response to climatic and edaphic drought. Plant Biology https://doi.org/10.1111/plb.13366.
Beitrag zum Ausdrucken
Weiterführende Informationen
Autoren





