LWF Wissen 89
Die Roteiche aus naturschutzfachlicher Sicht
von Dr. Stefan Muller-Kroehling und Olaf Schmidt
Mit der Roteiche (Quercus rubra L.) wurde vom Kuratorium Baum des Jahres eine nichtheimische Baumart zum Baum des Jahres gekürt. Aus Naturschutzkreisen wird sehr kritisch auf diese Wahl einer nichtheimischen Art reagiert (Dahl 2024, Erlwein et al. 2024, Natur-Garten e. V. 2024). Doch auch bereits an anderer Stelle wurde die Roteiche aus Naturschutzsicht eher kritisch gewürdigt (Aufderheide 2024). Aber ist diese Kritik aus Naturschutzsicht gerechtfertigt? Der folgende Beitrag versucht einen Überblick über die Roteiche v. a. aus ökologischer und naturschutzfachlicher Sicht im Lichte vorliegender wissenschaftlicher Studien zu geben. Dies soll als Grundlage für eine sachorientierte Diskussion verstanden und genutzt werden.
Hierbei gibt es zwei zentrale Fragen: Gibt es ökologische Auswirkungen des Roteichenanbaus und ist Roteiche in heimischen Ökosystemen als invasiv einzustufen?
Zu Geschichte und Umfang ihres Anbaus und Vorkommens in Deutschland wird auf die entsprechenden Beiträge in diesem Band verwiesen. Mit etwa 0,5 % Anteil an der Waldbestockung handelt es sich um die flächenbedeutsamste forstlich angebaute fremdländische Laubbaumart in Deutschland (Nagel 2015a).
Standortseigenschaften und -auswirkungen
 Zoombild vorhanden
Zoombild vorhanden
Abb. 1: Roteichenpflanzung auf nährstoffarmem Standort im Tertiärhügelland bei Landshut. Foto: S. Müller-Kroehling
Die Streu der Roteiche wird in Europa eher schlecht zersetzt, da sie ein höheres C/N-Verhältnis als Buche und heimische Eichen-Arten aufweist; darüber hinaus fehlen angepasste Streuzersetzer (Nagel et al. 2015a). Die schlechtere Streuzersetzung, v. a. in Roteichenreinbeständen, wird auch darauf zurückgeführt, dass Roteichenblätter meist flach zu Boden fallen und sich nicht kräuseln oder einrollen wie z. B. die Blätter unserer Eichenarten. Daher kann es am Boden zu dicken, plattigen Lagen von Roteichenblättern kommen (siehe Abbildung 1), die dem »Zugriff« der Bodenfauna mechanisch besser widerstehen können.
Eine Studie in Süd-Polen zu den Auswirkungen ihrer Beteiligung am Bestandsaufbau auf die Standortseigenschaften verglich eine große Zahl von Roteichen- mit Stieleichen-Beständen (Stanek & Stepanowicz 2019). Sie fand, »dass die gesamte mikrobielle und bakterielle Biomasse unter Q. rubra in beiden Bodenhorizonten deutlich geringer war als unter Q. robur. Die mikrobielle Gemeinschaftsstruktur des organischen Horizonts unterschied sich ebenfalls zwischen den beiden Quercus-Arten. Im Gegensatz dazu wurden keine Unterschiede in der Pilzbiomasse und den physikochemischen Bodenvariablen festgestellt«.
Waldbauliche Eigenschaften
Da sie für die Frage ihrer Integrierbarkeit in heimische Waldtypen und die Frage ihrer möglichen Invasivität relevant sind, sollen die besonderen waldbaulichen Eigenschaften der Roteiche kurz zusammengefasst werden.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 2: Roteichenstamm in ausgedehntem Nadelforstgebiet des Tertiärhügellandes. Foto: S. Müller-Kroehling
Die Roteiche tritt in ihrer nordamerikanischen Heimat meist als Mischbaumart auf. Aufgrund anderer Wuchsdynamik sind jedoch Mischungen mit heimischen Eichenarten in Mitteleuropa eher selten. Denn auf vielen Standorten würde dies zu einem deutlich erhöhten Aufwand der Mischwuchsregulierung oder zu einer nicht zielkonformen Mischung führen, in der die vorwüchsigen Roteichen die heimischen Eichen überwachsen und ausdunkeln würden. Auch das erreichbare Lebensalter der Roteiche unterscheidet sich und liegt mit ca. 400 Jahren deutlich unter jenem der heimischen Eichenarten.
Sie fruktifiziert etwa ab einem Alter von 20 – 25 Jahren erstmals, erbringt aber meist erst mit ca. 50 Jahren stärkere Masten; diese treten alle 2 bis 5 Jahre auf (Sander 1990) (vgl. auch G. Aas und B. Fussi et al. in diesem Band).
Biodiversität und Waldschutz
Flora und Vegetation
Die Untersuchung einer großen Zahl von Roteichenbeständen Polens (Chmura 2013) ergab erheblichen negativen Einfluss der Dichte von Roteichen und auch Roteichen-Keimlingen auf die Diversität und Zusammensetzung der Bodenpflanzen nach Vegetationsformen bzw. Vermehrungsstrategien sowie auch auf die Strauchschicht. Die Auswirkungen ähneln tendenziell denen der Rotbuche. Ähnlichkeiten zu Buchenbeständen bestehen auch in Bezug auf eine relative Armut vertikaler Strukturierung der Bestände, was auf das sehr dichte, schattige Blattwerk und auch auf allelopathische Wirkungen zurückzuführen ist. (Kucher et al. 2023).
Auch Woziwoda et al. (2014a) fanden erhebliche negative Einflüsse auf die charakteristische Phytodiversität natürlicher, primärer wie sekundärer Eichen-Kiefernwälder Polens sowie eine Einschränkung der natürlichen Verjüngung der heimischen Baumarten und die Unterdrückung zahlreicher heimischer Pflanzenarten. Keine einzige heimische Pflanzenart profitierte von der dominanten Beteiligung der Roteiche.
Bei den Bryophyten (Moose und Lebermoose) sind die Effekte gepflanzter Roteichen auf die Vielfalt nach Straten differenziert. Die auf dem Boden wachsenden Moose nehmen in ihrer Artenzahl und Verbreitung sehr deutlich ab (Woziwoda et al. 2017). Je nach Standortstypen können sie aber in einer polnischen Studie zwischen der Hälfte und zwei Dritteln der heimischen epiphytischen Bryophyten (auf Pflanzen wachsende Moose) beherbergen und insofern im Vergleich zu reinen Nadelforsten einer teilweisen Wiederherstellung dieser Pflanzenvorkommen dienen. Die Einbringung von Roteiche kann zur Erhöhung der Vielfalt auf Landschaftsebene der sogenannten Gamma-Diversität beitragen, insbesondere ist dies in reinen Nadelholzbeständen oder stark nadelholzdominierten Landschaftseinheiten der Fall (Gustafson et al. 2023).
Gleichwohl sind im Vergleich zu heimischen Eichenarten die Auswirkungen auf die epiphytischen Flechten weniger günstig (Gustafsson et al. 2023). Unter den epiphytischen Moosen und Flechten fanden sich auch Arten ausschließlich auf der Roteiche und zwar solche, die glatte Rinde bevorzugen und sonst auch auf Buchen vorkommen (Gustafsson et al. 2023). Die Autoren folgern, dass eine moderate Beteiligung von Roteichen die Artenvielfalt erhöhen kann, wenn die auf ihnen wachsenden Epiphyten sonst im Bezugsraum keine geeigneten Trägerbäume zur Verfügung haben. Unter den auf Roteiche gefundenen Epiphyten sind auch solche, die nur dort gefunden wurden (Kubiak 2006, Gustafsson et al. 2023). Einen Ersatz für die heimische Stieleiche oder allgemein heimische Eichenarten stellt die Roteiche jedenfalls für die epiphytischen Pflanzen nicht dar (Gustafsson et al. 2023).
In stark veränderten Landschaften wie Bergbaufolgelandschaften mit ihren Kippenaufforstungen spielen andere Faktoren eine wichtigere Rolle für die Artenzusammensetzung der Pflanzenartenvielfalt, wie unter anderem die räumliche Einbettung der Fläche (Denkinger & Wiegleb 2006, Nagel 2015a), etwa in Relation zu umgebenden Lebensräumen. Daher wirken sich in solchen Situationen auch Bestände mit Roteichen in den untersuchten Gebieten nicht ungünstig auf die untersuchten Artengruppen aus.
Zusammenfassend kann man zu den Auswirkungen auf die Pflanzenartenvielfalt sagen: in stark anthropogen überprägten und von Nadelforsten geprägten Landschaften mit ihren eher naturfernen Ausgangszuständen kann eine moderate Beteiligung eine Bereicherung darstellen (vgl. Abbildung 2). Eine starke oder gar dominante Beteiligung am Bestockungsaufbau oder ihre Einbringung in sehr naturnahen Beständen und geschützten Lebensräumen wirken hingegen gegenteilig und können die heimischen Waldpflanzen des Boden- und Stammraumes verdrängen.
Bodenfauna
Bodenbewohnende Milben- und hier speziell die Hornmilben (Oribatidae) sind sehr wichtige Zersetzergruppen der Laubstreu auf sauren Standorten, und wurden in einer umfassenden Studie in forstlich angebauten Vergleichsbeständen von Q. rubra und Q. robur auf sauren und armen Standorten Polens verglichen. Der Vergleich von Arten- und Individuenzahlen ergab sogar höhere Werte in den Roteichenbeständen (Kohyt & Skubala 2013), was sich auch gut durch ihre schlechtere Streuzersetzung gegenüber heimischen Eichen und Buchen erklärt, da Hornmilben ja vor allem an der Zersetzung ungünstiger Humusformen beteiligt sind. Auch ergab der Vergleich funktioneller Gruppen, der Struktur der Artengemeinschaften und des Vorkommens typischer Arten mitteleuropäischer Laubwald-Mikrohabitate, dass die Roteichenbestände gestörte und an Laubwaldspezialisten verarmte Artenzusammensetzungen und deutlich weniger Spezialisten und Arten mit sexueller Reproduktionsweise aufwiesen, im Vergleich zu sich asexuell vermehrenden Generalisten (Kohyt & Skubala 2020). Die Autoren sehen den bestandsweisen Anbau dieser Baumart im Vergleich zur heimischen Stieleiche in Hinsicht auf die Zusammensetzung auf diese für die Streuzersetzung und auch als Indikatoren wichtige Gruppe der Bodenmesofauna daher als ungünstig an.
Balkenhol et al. (2006) untersuchten in einer unechten Zeitreihe von Roteichenbeständen auf Bergbaurekultivierungsböden die Kurzflügelkäfer (Staphylinidae)- und Hundertfüßer (Chilopoda) -Fauna und verglichen sie mit Roteichen- und Traubeneichenbeständen auf gewachsenem Boden. Ein Einfluss der Eichenart auf die zoophage Bodenfauna konnte nicht festgestellt werden, vielmehr erwies sich als bedeutend, ob es sich um einen gestörten oder ungestörten Boden handelte. Auch auf die Spinnen in der Krautschicht gab es keinen Einfluss der Eichenart (Balkenhol 2006), wie er in anderen Untersuchungen für die höheren Strata des Bestandes (Kronenraum) nachgewiesen worden war (Gosner 2002 und 2004a). Insgesamt trugen Q. rubra-Bestände wiederum in der speziellen Situation einer Bergbaufolgelandschaft positiv zur Gesamtdiversität bei (Nagel 2015a), was jedoch nicht auf die Normallandschaft übertragbar ist.
Blattfressende Insekten
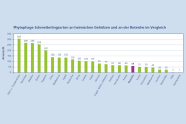 Zoombild vorhanden
Zoombild vorhanden
Abbildung 3: Phytophage Schmetterlingsarten an heimischen Gehölzen und an der Roteiche im Vergleich. Quellen: Brändle/Brandl 2001 und Sobczyk 2019 (Roteiche)
Das Auftreten von Gattungsspezialisten der Eichen oder anderweitig besonders spezialisierten Arten an der Roteiche ist eher selten, aber es gibt Ausnahmen.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 4: Raupe des eher seltenen Südlichen Zahnspinners (Drymonia velitaris) in Brandenburg. Foto: Rämisch
 Zoombild vorhanden
Zoombild vorhanden
Abb. 5: Der aus Nordamerika stammende Roteichen-Zwergwickler (Bucculatrix ainsliella Murtfeld). Foto: D. Robrecht, lepiforum.org
Die Besiedlung der Eicheln durch Eichelbohrer-Arten ist bei der Roteiche sehr viel geringer als bei heimischen Eichen (Gosner 2005, Gosner & Simon 2005, Myczko et al. 2017). Bei den in Eicheln lebenden Schmetterlingsarten wie dem Eichelwickler sind die Roteichen insgesamt auch weniger besiedelt und bieten offenbar nur einem Teil der Arten einen geeigneten Lebensraum (Kelbel 1969). Grund könnte sein, dass die einheimischen Minierer nicht an die zweijährige Entwicklungszeit der Roteicheln angepasst sind (Dressel & Jager 2002). Die Besiedlung von Eicheln der Roteiche im Vergleich zu den heimischen Eichenarten zeigt allerdings beispielsweise deutliche Unterschiede zwischen Italien und Polen und legt nahe, dass regionale Verfügbarkeit der Ressourcen eine Rolle spielt, wie etwa des größeren Volumens der Roteicheln im Vergleich zu den untersuchten Eicheln in einer Studie in Italien, was zur bevorzugten Besiedlung durch manche in den Eicheln nistenden Ameisen-Arten führte (Giannetti et al. 2022).
Insgesamt ist die Roteiche bei den phytophagen Insekten als individuen- und artenärmer einzustufen als unsere heimischen Eichenarten. Grund ist die fehlende Anpassung an Morphologie und Blattinhaltsstoffe dieser speziellen Art (Assel 2022). An der Roteiche kommen daher vorwiegend Generalisten unter den Blattfressern vor, und viele Eichen-Spezialisten können die Roteiche nicht oder nur sehr wenig nutzen (Gosner & Gruppe 2003, Gosner 2004b).
Räuberische und parasitäre Wirbellose
Bei den räuberischen Bewohnern des Blattraumes, wie den Netzflüglern (Neuroptera), den Blattlausantagonisten als Gilde, den monophag Eichen besiedelnden Arten sowie auch den Antagonisten unter den Hautflüglern (Schlupfwespen u. a.) sind die Abundanzen oder aber Artenzahlen gegenüber der Stieleiche deutlich geringer. Aufgrund fehlender Spenderhabitate sind Roteichen-Reinbestände dabei besonders negativ zu bewerten (Gosner 2004b).
Den Kronenraum bewohnende Spinnen kommen in Roteichenkronen durchaus arten- und individuenreich vor, die deutlich anders strukturierte Stammoberfläche fällt hingegen gegenüber den heimischen Eichen stark ab (Gosner 2004b).
Xylobionte Arten, insbesondere Käfer
Aufgrund der Raschwüchsigkeit der Roteiche fällt im Vergleich zu den heimischen Eichen relativ schnell starkes Totholz an (Gosner 2004b). Allerdings erwies sich die Artenzahl totholzbewohnender Arten trotz nicht geringerer Kronentotholzmengen als niedriger (Gosner 2004a).
Unter den xylobionten Arten besiedeln vor allem solche die Roteiche, die bereits von Pilzen zersetztes Holz nutzen. Nach den Untersuchungen von Vogel et al. an 42 Baumarten zu den xylobionten Käferarten wird das Holz der Roteiche ähnlich gerne von den Xylobionten angenommen, wie das Holz der Stiel- und der Zerreiche. Vogel et al. (2020) verglichen die Besiedlung verschiedener Baumarten in kontrollierten Brutsubstratversuchen durch xylobionte Käferarten im Freiland, und fanden Q. rubra neben den einheimischen Eichenarten als eine der Arten mit höchster Alpha-Diversität, verglichen mit den heimischen Eichenarten jedoch geringerer Gamma-Diversität. Sie stellten auch an Roteiche in nennenswertem Umfang das Vorkommen gefährdeter Arten fest.
Das Totholz von Q. rubra wird auch rascher zersetzt als jenes der heimischen Eichen (Moller 1998). Seine Attraktivität für verschiedene Arten von Ambrosiapilze züchtenden, xylophagen Käfern der Gruppe Xyleborus, die maßgeblich an den frühen Zersetzungsphasen beteiligt sind, zeigten Faccoli & Rukalski (2004). Die entstehenden Strukturen können von typischen Totholzinsekten genutzt werden. Moller (1998) fand drei überregional stark gefährdete Schnellkäferarten im Totholz von Q. rubra.
 Zoombild vorhanden
Zoombild vorhanden
Abb. 6: Der Eichen-Heldbock (Cerambyx cerdo) als Beispiel für die zahlreichen Eichenspezialisten, die die Roteiche bestenfalls sehr eingeschränkt oder nicht nutzen können. Foto: A. Kanold
Mulmhöhlenbewohner wie die FFH-Art Eremit (Osmoderma eremita) finden in der Roteiche weniger günstige Habitatbäume schon wegen der geringeren Lebensdauer gegenüber den heimischen Eichen- und anderen sehr alt werdenden Baumarten wie den Linden (Tilia). Nachweise des Eremiten aus Roteichen aus Europa sind offenbar bisher nicht bekannt geworden. Vorkommen dieses und anderer Mulmhöhlenbewohner sind jedoch in aller Regel nicht auf bestimmte Baumarten beschränkt und auch Vorkommen in nichtheimischen Baumarten wie der Ahornblättrigen Platane (Platanus acerifolia) sind bekannt.
Sowohl Rot- als auch Traubeneiche haben vergleichenden Erhebungen in Tschechien (Vele et al. 2023) zu verschiedenen Gruppen der wirbellosen und Wirbeltierfauna zufolge speziell an ihr nachgewiesene Arten. Allerdings ist das Vorkommen von Eichen-Spezialisten weitgehend auf die heimischen Arten beschränkt.
Die Anpassung phytophager und xylophager Insektenarten speziell an Eichen (Gattung Quercus) unterscheidet sich für viele Arten je nach den verschiedenen Sektionen innerhalb der Baumgattung. Das zeigt sich auch zwischen den heimischen Weißeichen und den in Mitteleuropa nicht einheimischen Roteichen, zu denen Quercus rubra gehört (Nagel 2015a). Entsprechend kommt Gosner (2004a, 2004b) zu dem Schluss, dass zwar etliche Arten auf der Roteiche leben, darunter aber nur relativ wenige bzw. kaum gattungstypische Spezialisten sind, während gerade die heimischen Eichen über eine besonders große Zahl angepasster Arten verfügen. Nagel (2015) fasst zusammen: »ausgesprochen stenophagen, an die heimischen Eichen angepassten Arten, insbesondere hoch spezialisierten Insekten, kann die Roteiche dagegen nicht oder nur eingeschränkt als Lebensgrundlage dienen«.
Gosner (2004b) beschreibt diesen Zusammenhang als eine »nicht gesättigte Artengemeinschaft«, also eine Artenzusammensetzung, die wenig spezifisch ist, sondern vor allem Opportunisten und Generalisten enthält. Sobczyk (2019) bezweifelt, dass Biodiversität und Individuenzahl sich zukünftig den Zahlen an heimischen Eichenarten annähern werden, da auch in Nordamerika ein deutlicher Unterschied zwischen den Arten, beispielsweise der Gallwespen, zwischen Rot- und Weißeichen bestehe.
Mykoflora
Laut Nagel (2015a) „ist Q. rubra ebenso wie die heimischen Eichenarten eine ausgesprochen mykotrophe Baumart. Sammler et al. (2011) fanden 115 verschiedene Ectomykorrhizapilze an der Roteiche. In einem Roteichenbestand auf einem Rekultivierungsstandort in der Lausitz waren bei Kronenschluss im Alter von 20 Jahren 100 % der Bäume mykorrhiziert, deutliche Unterschiede in den Ectomykorrhizagemeinschaften von Roteiche und Traubeneiche wurden nicht gefunden (Gebhardt et al. 2006).“ Sammler et al. (2011) wiesen in Brandenburg 120 lignikole Pilzarten an Q. rubra nach, darunter zahlreiche in Brandenburg bzw. Deutschland seltene bzw. gefährdete Arten.
Nagel (2015a) sieht bereits „Ansätze einer ökologischen Integration sind vor allem durch die Besiedlung mit zahlreichen Pilzen, die am Anfang von Nahrungsketten stehen und zur Schaffung geeigneter Strukturen für einheimische Lebensgemeinschaften beitragen.“
Vogelwelt
 Zoombild vorhanden
Zoombild vorhanden
Abb. 7: Zur Aufnahme von Baumsaft geringelter Roteichenstamm – Verursacher vermutlich der Buntspecht. Foto: N. Wimmer
Weitere Vogelarten, die Roteicheln verzehren können, sind z. B. Ringeltaube und Rabenkrähe (Turcek 1961). Die Roteiche wird von Buntspechten gerne als Ringelbaum genutzt (siehe Abbildung 7), sogar noch bevorzugt vor der Stieleiche, wenn auch deutlich weniger stark als Linde, Ahorn und Hainbuche (Guenther 2020, Guenther & Wimmer 2024).
Ausbreitungsverhalten und mögliche Invasivität
Klimawandelanpassung
Nichtheimische Baumarten können helfen, den Zusammenbruch von Forst- und Waldbeständen durch Schadereignisse oder andere negative Entwicklungen, wie z. B. ein Überhandnehmen von Brombeeren in durch Luftstickstoff überdüngten Beständen, abzufedern. Doch bleiben auch diese Baumarten auf Dauer nicht „unverwundbar“ gegen abiotische und biotische Schäden und Extremereignisse, wenn sie außerhalb ihres ökologischen Optimums angebaut werden.
Nicolescu et al. (2020) fassen Arbeiten zusammen, die für eine geringere Empfindlichkeit gegenüber Trockenheit und Dürre und damit für ein höheres Klimawandel-Adaptionspotenzial sprechen als bei den heimischen Eichenarten. Auch Di Iorio et al. (2024) bewerten das Feinwurzelsystem als „besonders konkurrenzkräftig in den Trockenphasen in den Kronenlücken während des Sommers zumindest im Sämlingsstadium.“ Lockwood et al. (2023) sehen sie im direkten Vergleich mit der Weißeichen-Art Quercus alba geringfügig besser an zunehmende Trockenphasen angepasst, auch wenn erstere ein weiter nach Süden reichendes Verbreitungsgebiet aufweist. Beide Arten sind infolge vielfältiger Ursachen einschließlich des Klimawandels in Nordamerika rückläufig (Lockwood et al. 2023).
Die Roteiche oder Northern Red Oak (Quercus rubra L.) ist andererseits eine nordische Baumart, was auch das alte wissenschaftliche Synonym Quercus borealis anzeigt. Ihr relativ weit in den Süden der USA reichendes Verbreitungsgebiet wird durch andere Unterarten und in etwas höher gelegenen Bereichen der Südstaaten erreicht. Beachtet werden müsste also bei Analysen ihrer Eignung auch in zukünftigen Klimaten, dass die Roteiche über zwei auch morphologisch unterscheidbare Varietäten verfügt, die sich zwar in erheblichen Teilen überlappen, aber in der nördlichen und südlichen Hälfte des amerikanischen Areals auch getrennt auftreten (Nagel 2015a).
Anbauschwerpunkte innerhalb Europas liegen im Baltikum (z. B. Woziwoda et al. 2014b). Dort sind daher auch die ökologischen Auswirkungen ihres Anbaus bisher am gründlichsten untersucht worden. Diese Großregion weist indes nicht die Klimabedingungen auf, die unseren zu erwartenden zukünftigen entsprechen.
Verjüngungsverhalten und spontanes Ausbreitungsverhalten
Die Roteiche kann sich sowohl in strauchreichen, zwergstrauchreichen als auch moosigen Bereichen von Kiefernforsten gut verjüngen (Woziwoda et al. 2023). Nach zweihundert Jahren intensiven forstlichen Anbaus in Polen und trotz eines nur geringen Bestockungsanteils von 0,16 % hat sich die Art dort sehr weit verbreitet, mit über 80.000 bekannten Lokalitäten (Woziwoda 2014b).
Im Rahmen eines Forschungsprojekts wurden im Ebersberger Forst in unterschiedlich alten Fichtenreinbeständen bzw. Fichten-Buchen-Mischbeständen insgesamt 108 Vegetationsaufnahmen (Flächengröße 400 m2) durchgeführt (Kudernatsch et al. 2021). Dabei zeigte sich, dass die Roteiche – obwohl innerhalb der Baumschicht der untersuchten Flächen kaum vertreten (Stetigkeit unter 2 %) – in der Krautschicht mit einer Stetigkeit von über 70 % zu den häufigsten Arten zählte. Die mit 83 % der Aufnahmen höchste Vorkommenshäufigkeit erreichte die Roteiche dabei in den Verjüngungsnutzungsbeständen, während die Stetigkeit in den jüngeren und noch weitgehend geschlossenen Jung- und Altdurchforstungsbeständen mit 64 % niedriger war (vgl. Kudernatsch et al. 2021). Die Deckung der Baumart innerhalb der Krautschicht betrug dabei aber in keinem Fall mehr als ein Prozent, weshalb eine erfolgreiche, längerfristige Etablierung der Baumart in den Folgebeständen zwar insgesamt noch nicht gesichert ist. Die Roteiche erweist sich aber jedenfalls unter den gegebenen Bedingungen durchaus zur spontanen Verjüngung und einer effektiven Ausbreitung in den Raum hinein befähigt. Eine dauerhafte Etablierung und das Ausmaß ihrer spontanen Ausbreitung werden aber bei einer überwiegend schattig-geschlossenen Ausgangsbestockung aus Fichtenforsten und Buchen-Unterbauten auch von der weiteren Vegetationsentwicklung im Gebiet abhängen.
Die Roteiche gilt in Nordamerika als empfindlich auf Wildverbiss reagierend bzw. Wildverbiss als eine Ursache für ihre rückläufige Beteiligung an den Bestockungen (Nagel 2015a).
Auch für Deutschland gilt, dass die Art von Wildverbiss durch Rehe »eine stark präferierte Art« ist (Gohre & Wagenknecht 1955, Vor 2005). Die Roteicheln werden gern von Schwarz- und Rotwild aufgenommen (Nagel 2015).
Q. rubra kann Waldbrände in Form leichterer Bodenfeuer besser überstehen als heimische Baumarten (Nagel 2015a) und durch Stockausschläge danach wieder regenerieren, was v. a. auf leichten Böden in niederschlagsarmen Regionen und auf militärischen Übungsplätzen mit ihrer großen Bedeutung für den Erhalt nährstoffarmer Ökosysteme eine erhebliche Bedeutung haben kann.
Eindringen in geschützte Lebensräume
Aus der Sächsischen Schweiz ist ein Eindringen der Art in geschützte Lebensräume auf flachgründigen Sonderstandorten, die für die Artenvielfalt wegen der vorkommenden Lebensraumspezialisten eine besonders große Bedeutung haben, gut dokumentiert (Dressel & Jager 2002). Die Art tritt in diesen Lebensräumen wie Felsriffen, Felsterrassen, Felskanten und am Fuß südexponierter Felshänge in dominanter und für die Erreichung der Naturschutzziele unerwünschter Weise auf. Die geradezu bevorzugte Besiedelung der südexponierten Standorte ergibt sich durch die Konkurrenzüberlegenheit auf diesen Standorten, etwa gegenüber den heimischen Eichen (Dressel & Jager 2002). Auch Nagel (2015a) sieht zumindest »punktuell bestehende oder potenzielle Konflikte mit naturschutzfachlichen Zielen in lichten und warmen Sonderbiotopen, die vor allem aus der beschattenden Wirkung der Baumart resultieren«, kommt aber zu dem Schluss, diese ließen sich durch die Berücksichtigung potenzieller Ausbreitungsentfernungen beim Anbau bzw. durch die relativ einfache und sichere Beseitigung von Verjüngungspflanzen lösen. Dem sind aber zumindest in den Kernzonen von Großschutzgebieten und in Privatwaldflächen in Schutzgebieten seitens der Rahmenbedingungen Grenzen gesetzt: in Kernzonen müssen in der Regel Managementmaßnahmen unterbleiben, und im Privatwald sind solche Maßnahmen in der Regel auch in Schutzgebieten freiwillig.
Invasivitätsbewertung
Die Invasivitätsbewertung erfolgte durch das BfN 2014 (Lauterbach & Nehring 2014). Das BfN klassifiziert die Art als solche der »Schwarzen Liste« (invasiver Arten, im Gegensatz zur »Grauen Liste« potenziell invasiver Arten), in der Unterkategorie »Managementliste« (im Gegensatz zur »Aktionsliste«, die auf eine aktive Bekämpfung hinausläuft).
Für Auswirkungen und Management nennt die Arbeit folgende Aspekte:
- „Reproduktionspotenzial: Gering; später Eintritt in die Fruchtreife (frühestens nach 25 Jahren, Kowarik 2010)“
- Ausbreitungspotenzial: Hoch; Natürliche Fernausbreitung der Früchte durch Vögel, jedoch präferieren Eichelhäher bei bestehender Wahl die Früchte von heimischen Stiel- und Trauben-Eichen deutlich und verschmähen meist die Eicheln der Roteiche (Dressel & Jager 2002, Bieberich et al. 2016)
- Aktueller Ausbreitungsverlauf: unbekannt; der forstliche Anbau in Deutschland ist rückläufig (Starfinger & Kowarik 2008), Zunahme der Fundorte in Polen (Tokarska-Guzik 2005)
- Einflüsse auf Bodenbildung und Vegetationsstrukturen (Roteichenlaub ist schwer abbaubar, Dressel & Jager 2002, Hetzel 2006), Veränderung von Nahrungsbeziehungen
- Förderung des Invasionsrisikos durch Klimawandel wird angenommen (Roloff & Grundmann 2008, Kleinbauer et al. 2010)“
Einen – allerdings unvollständigen – Überblick über die Invasivitätsbewertungen in verschiedenen europäischen Ländern geben Nicolescu et al. (2020), die Invasivitätsbewertung durch das BfN (2014) fehlt hier. Beispielsweise in der Ukraine verhält sich die Art invasiv und kann natürliche Laub- und Nadelwaldarten in ihren Waldgesellschaften verdrängen (Kucher et al. 2023).
Für die Sächsische Schweiz und den dortigen Sonderfall des Schutzes der seltenen Felsspalten-Gesellschaften wird auf Basis umfassender Erhebungen eine Bekämpfung empfohlen (Dressel & Jager 2002). Als Bekämpfungsmöglichkeiten und Vermeidungsmaßnahmen nennt das BfN (Nehring et al. 2014):
- „Mechanische Bekämpfung, häufiges Zurückschneiden oder Rodung des Wurzelstocks, da die Art Stockausschlag bildet (Starfinger & Kowarik 2008)
- Verhinderung absichtlicher Ausbringung, in der Nähe von Felsbiotopen und lichten Eichenwäldern (Starfinger & Kowarik 2008)“
Da fast alle Roteichenbestände in Deutschland nicht durch spontane Naturverjüngung der Roteiche, sondern durch gezielte menschliche Maßnahmen, wie Saat und Pflanzung, entstanden sind, und der Eichelhäher als Vektor für die Ausbreitung nicht relevant ist, verneinen viele Forstwissenschaftler eine Invasivität der Art (Nagel 2015, Roloff 2025).
Nagel (2015) stuft sie für Deutschland als „nicht invasiv“ ein. Berichte über die Invasivität der Roteiche aus anderen europäischen Ländern wie Belgien und den Niederlanden zeigen eine Zunahme der Naturverjüngung der Roteiche vor allem unter dem lichten Schirm von Kiefernbeständen auf armen Sandstandorten auf. Allerdings liegen die Anteile von fruktifizierenden Roteichen an der Gesamtbestockung dort auch viel höher (z. B. in Flandern ca. 5 %) als in Deutschland (Nagel 2015).
Auch der Wissenschaftliche Dienst des Deutschen Bundestages (2018) erkennt bei der Roteiche keine Invasivität, da die Roteiche kein hohes Ausbreitungspotenzial besitze, die Fähigkeit, Arten zu verdrängen auf sie ebenfalls nicht zutreffe und bei der Roteiche waldbauliche Steuerungsmöglichkeiten bestünden. Alle diese Gründe führen zu der Einwertung des Wissenschaftlichen Dienstes, dass die Roteiche in Deutschland keine invasive Baumart darstellt.
Gleichzeitig zeigen die Beispiele aus dem Baltikum und aus Ländern mit größerer Beteiligung der Roteiche an der Anbaufläche, aber selbst bei nur geringen Bestockungsanteilen und auch aus hiesigen Waldgebieten wie dem Ebersberger Forst, gleichwohl ein erhebliches Ausbreitungspotenzial der Art in Waldgebieten. Zumindest in strengen Schutzgebieten, in denen ihre spontane Verbreitung ein Problem darstellen kann, wie etwa das Beispiel der Sächsischen Schweiz zeigt, sollte der Anbau daher aus naturschutzfachlicher Sicht unterbleiben.
Schlussfolgerungen
Roteichen können vor allem in eher monostrukturierten Wirtschafts-Wäldern wie Nadelholzreinbeständen eine Bereicherung der Bestockung auch für die Biodiversität darstellen. Dies ist jedoch überwiegend nicht für hochspezialisierte, sehr anspruchsvolle Arten der Fall. Heimische Eichen-Arten, die – was die auf sie spezialisierten Arten betrifft – zu den reichsten Pflanzenarten Europas gehören, kann die Roteiche aus Artenschutzsicht nicht ersetzen. Die Invasivität der Roteiche in einer Region kann meist erst dann beurteilt werden, wenn sie in dieser Region bereits in der Etablierungsphase ist. Trotz geringerer Attraktivität für den Eichelhäher findet sie bei zusagenden Standortsbedingungen auch aus relativ geringen Bestockungsanteilen heraus den Weg in die umliegenden Bestände, wie die Bespiele aus Sächsischer Schweiz und Ebersberger Forst zeigen. Auf flachgründigen und trockenen Sonderstandorten kann ihre Konkurrenzüberlegenheit zu naturschutzfachlichen Problemen führen.
In Zeiten des Klimawandels sollten in unseren Wäldern bevorzugt unsere heimischen und klimastabilen Eichenarten, Stiel- und Traubeneiche, gepflanzt oder gesät werden.
An zweiter Stelle können und sollten vor allem süd- und südosteuropäische Eichenarten, wie z. B. Flaum-, Zerr- und Balkaneiche und die den Eichen nahestehende Edelkastanie, beim klimastabilen Waldumbau beteiligt werden. Erst an dritter Stelle sollte man bei den Eichenarten auch an die Roteiche denken, d.h. vor allem dann, wenn die heimischen Eichenarten keine Alternative darstellen.
Als zusätzliche Baumart im Sinne einer „bedachten Anreicherung“ jedoch kann die Roteiche unsere artenarme Baumartenpalette als Mischbaumart vor allem in zum Waldumbau anstehenden Nadelwaldgebieten auf nährstoffarmen Ausgangsstandorten sinnvoll ergänzen.
Wichtig ist dabei aus Naturschutzsicht, die Roteiche nicht als führende Hauptbaumart einzubringen, sondern als Mischbaumart. Dies gilt im übertragenen Sinne auch für gemischte Alleen und Baumbestände im urbanen Grün, wo die Roteiche durch ihre prächtige Herbstfärbung eine auch ästhetisch ansprechende Baumart darstellt.
Literatur
- Assel, M. (2022): Einfluss von geografischer und phylogenetischer Distanz auf die Arthropodendiversität innerhalb der Gattung Quercus in einer ›common garden‹-Studie. Master-Arbeit, Universität Bayreuth
- Aufderheide, U.; Peters, C.; Mody, K.; Marxen-Drewes, H. (2024): Zukunfts- oder Klimabäume – Wie gut sind die Arten zur Förderung der Biodiversität geeignet? Naturschutz und Landschaftsplanung 56 (08), S. 14-23
- Balkenhol, B.; Brunk, I.; Vogel, J.; Voigtlander, K.; Xylander, W. (2006): Sukzession der Staphyliniden- und Chilopoden-Coenosen eine Roteichen-Chronosequenz im Vergleich zu Offenlandflächen und Traubeneichenwäldern. – In Bröring, U. & Wiegleb, G. (Hrg.): Biodiversität und Sukzession in der Niederlausitzer Bergbaufolgelandschaft. – Norderstedt, S. 45-61
- Bauer, F. (1953): Die Roteiche. – Frankfurt a. M. 108 S.
- Bieberich,J.; Lauerer, M.; Aas, G. (2016): Acorns of introduced Quercus rubra are neglected by European Jay but spread by mice. – Ann. For. Res. 59(2): 249-258
- Brandle, M.; Brandl, R. (2001): Species richness of insects and mites on trees: expanding southwood, Journal of Animal Ecology 70: 491-504
- Brandstetter, R. (2002): Der Eichelhäher – Monographie und Experiment zu Sammel- bzw. Nahrungspräferenzen, Facharbeit Hans-Carossa Gymnasium Landshut, 27 S.
- Chmura, D. (2013): Impact of alien tree species Quercus rubra L. on understorey enviroment and flora: as study of the Silesian Upland (Southern Poland). – Pol. J. Ecol. 61(3): 431-442
- Dahl, A. (2024): Naturschutz auf den Kopf gestellt: Die Roteiche wird Baum des Jahres, Melanargia, 28.10.2025
- Di Iorio, A.; Caspani, A.C.; Beatrice, P.; Montagnoli, A. (2024): Drought-related root morphological traits and non-structu ral carbohydrates in the seedlings of the alien Quercus rubra and the native Quercus robur: possible implication for invasiveness. – Front. For. Glob. Change 7:1307340. doi: 10.3389 & ffgc.2024.1307340
- Dressel, R.; Jager, E.J. (2002): Beiträge zur Biologie der Gefäßpflanzen des herzynischen Raumes 5. Quercus rubra L. (Roteiche): Lebensgeschichte und agriophytische Ausbreitung im Nationalpark Sächsische Schweiz. – Hercynia (N.F.) 35: 37-64
- Erlwein, M.; Bernhardt, S.; Back, F. (2024): Deutliche Kritik am Baum des Jahres: Auszeichnung für Roteiche ist falsches Signal, LBV-Presseinformation 114-24
- Fuchs, R.; Hetzel, I.; Loos, G.H.; Kell, P. (2006): Verwilderte Zierund Nutzgehölze in Wäldern des Ruhrgebietes, AFZ & Der Wald 12, S. 622-625
- Gebhardt, S.; Wollecke, J.; Munzenberger, B.; Huttl, R.F. (2006): Sukzession der Diversität von Ektomykorrhizapilzen in Roteichen-Ökosystemen (Quercus rubra L.) in der Niederlausitzer Bergbaufolgelandschaft. In: Biodiversität und Sukzession in der Niederlausitzer Bergbaufolgelandschaft. Books on Demand, Norderstedt, S. 112-136
- Gohre, K.; Wagenknecht, E. (1955): Die Roteiche und ihr Holz. Berlin: Deutscher Bauernverlag. 300 S.
- Gosner, M. (2004): Diversität und Struktur arborikoler Arthropodenzönosen fremdländischer und einheimischer Baumarten Untersuchung ausgewählter Arthropodengruppen für eine faunistisch-ökologische Bewertung des Anbaus von Douglasie (Pseudotsuga menziesii (Mirb.) Franco) und Amerikanischer Roteiche (Quercus rubra L.). – Diss. TU München, Lehrstuhl für Landnutzungsplanung, 241 S.+Anh.
- Giannetti, D.; Schifani, E.; Castracini, C.; Spotti, F.A.; Mori, A.; Grasso. D.A. (2022): The introduced oak Quercus rubra arthropods in Europe: An opportunity for insects and their ant predators. – Ecological Entomology 47: 515-526
- Gosner, M. (2004): Diversität und Struktur arborikoler Arthropodenzönosen fremdländischer und einheimischer Baumarten. Neobiota 5: 1-241
- Gosner, M. (2004): Nicht tot, aber sehr anders! – Arthropodenfauna auf Douglasie und Amerikanischer Roteiche – LWF aktuell 45: 10-11
- Gosner, M. (2005): Von Eichelbohrern und Eichelwicklern auf eingeführten und einheimischen Eichen, LWF-aktuell 49: 18-19
- Gosner, M.; Brau, M. (2004): Die Wanzen der Neophyten Douglasie (Pseudotsuga menziesiii) und Amerikanischer Rot- Eiche (Quercus rubra) im Vergleich zur Fichte und Tanne bzw. Stiel-Eiche und Buche in südbayerischen Wäldern. Schwerpunkt arboricole Zönosen (Insecta: Heteroptera). – Beitr. Bayer. Entomofaunistik 6: 217-235
- Gosner, M.; Gruppe, A. (2003): Befall von Eicheln einheimischer (Quercus robur) und eingeführter (Quercus rubra) Eichen durch Eichelbohrer (Curculio sp.) und Eichelwickler (Tortricidae) – Zusammenspiel von Inhaltsstoffen und Schlupfrate. – Mitt. Dtsch. Ges. Allg. Angew. Ent. 14: 41-44
- Gosner, M.; Hausmann, A. (2009): DNA barcoding enables the identification of caterpillars feeding on native and alien oak (Lepidoptera: Geometridae). – Mitt. Münchn. Ent. Ges. 99: 135-140
- Gunther, E. (2020): Zum Ringeln der Spechte Dendrocopos im Tiergarten Hannover, Ornithologische Mitteilungen 72, 3, S. 59-66
- Gunther, E.; Wimmer, N. (2024): Das Ringeln der Spechte – ein Phänomen mit vielen Profiteuren, Der Falke 3, S. 36-39
- Gustafson, L.; Franzen, M.; Sunde, J.; Johannsson, V. (2023): The non-native Quercus rubra does not substitute the native Quercus robur and Q. petraea as substrate for epiphytic lichens and bryophytes. – Forest Ecol. Manage 549 (2023) 121482
- Hauck, M. (2023): Zeitenwende im Wald: Klimawandelanpassung durch Ersatzbaumarten eine langfristige Lösung? – Natur und Landschaft 98 (11), S. 516-522
- Kleinbauer, I.; Dullinger, S.; Klingenstein, F.; May, R.; Nehring, S.; Essl, F. (2010): Ausbreitungspotenzial ausgewählter neophytischer Gefäßpflanzen unter Klimawandel in Deutschland und Österreich. BfN-Skripten 275: 74 S.
- Kowarik, I. (2010): Biologische Invasionen (2. Aufl.). – Stuttgart, 492 S.
- Kubiak, D. (2006): Lichens of red oak Quercus rubra in the forest environment in the Olsztyn Lake District (NE Poland). – Acta Mycol. 41: 319-328 (https: & & doi.org & 10.5586 & am.2006.033.)
- Kohyt, J.; Skubala, P. (2013): Communities of mites (Acari) in litter and soil under the invasive red oak (Quercus rubra L.) and native pedunculate oak (Q. robur L.). – Biological letters 50(2): 111-124
- Kohyt, J.; Skubala, P. (2020): Oribatid mite (Acari: Oribatida) communities reveal the negative impact of the red oak (Quercus rubra L.) on soil fauna in Polish commercial forests. –Pedobiologia 79(2020): 150594.
- Kucher, O.O.; Didukh, Y.P.; Pashkevych, N.A.; Zaviolova, L.V.; Rozenblit, Y.V.; Orlov, O.O.; Shevera, M.V. (2023): The impact of northern red oak (Quercus rubra; Fagaceae) on the forest phytodiversity in Ukraine. – Ukr. Bot. J. 80(6); 453-468
- Kudernatsch, T.; Schauer, B.; Walentowski, H. (2021): Auswirkungen des Waldumbaus von Fichtenforsten zu Fichten-Buchen- Mischbeständen auf Vegetation und Humusschicht – Tuexenia 41: 109-132
- Lauterbach, D.; Nehring, S. (2013): Quercus rubra L. in: Nehring, S.; Kowarik, I., Rabitsch, W. & Essl, F. (2013, Hrsg.) Naturschutzfachliche Invasivitätsbewertungen für in Deutschland wild lebende gebietsfremde Gefäßpflanzen. Bonn: BfN-Skripten 352, S. 162-163
- Lockwood, B.R.; Maxwell, J.T.; Denham, S.O. et al. (2023): Interspecific differences in drought and pluvial responses for Quercus alba and Quercus rubra across the eastern United States.– Agricultural and Forest Meteorology 340, 15 September 2023, 109597 https: & & doi.org & 10.1016 & j.agrformet.2023.109597
- Moller, G. (1998): Hinweise zur Berücksichtigung von Aspekten des Schutzes holzbewohnender Insekten und Pilze beim Umgang mit neophytischen Gehölzen Novius, Mitteilungsblatt der Fachgruppe Entomologie Berlin 23, 524-534
- Mayer, J.; Baumhauer, C.; Schabel, A. (2017): In die Zange genommen: Der Hirschkäfer an Roteiche. FVA-einblick 3/2017: 15-17
- Muller-Kroehling, S.; Franz, C.; Binner, V.; Muller, J.; Pechacek, P.; Zahner, V. (2006): Artenhandbuch der für den Wald relevanten Tier- und Pflanzenarten des Anhanges II der Fauna-Flora-Habitat-Richtlinie und des Anhanges I der Vogelschutz-Richtlinie in Bayern (4. Aktualisierte Fassung). – Freising, 187 S.+Anh.
- Myczko, L.; Dylewski, L.; Chrzanowski, A.; Sparks, T.H. (2017): Acorns of invasive Northern Red Oak (Quercus rubra) in Europe are larval hosts for moths and beetles. – Biol. Invasions 19: 2419-2425
- Nagel, R.-V. (2015a): Quercus rubra. In: Vor, T., Spellmann, H., Bolte, A. & Ammer, C. (Hrsg.): Potenziale und Risiken eingeführter Baumarten. Baumartenportraits mit naturschutzfachlicher Bewertung. Göttinger Forstwissenschaften, Bd. 7, S. 219-267
- Nagel, R.-V. (2015b): Die Roteiche in Norddeutschland. Ergebnisse von Versuchsflächen der Nordwestdeutschen Forstlichen Versuchsanstalt in Niedersachsen, Schleswig-Holstein und Sachsen-Anhalt. – Mitt. Ges. schnellwaschsende Baumarten in Norddeutschland 5 & 2015: 1-16
- NaturGarten e.V. (2024): »Baum des Jahres« gefährdet die Biodiversität: NaturGarten e.V. kritisiert die Wahl der Amerikanischen Rot-Eiche zum Baum des Jahres: ein hoher Preis
- Nehring, S.; Essl, F.; Rabitsch, W. (2013): Methodik der naturschutzfachlichen Invasivitätsbewertung für gebietsfremde Arten, Version 1.2. BfN-Skripten 340: 46 S.
- Neumann, V. (1985): Der Heldbock. – Wittenberg, 103 S.
- Neumann, V.; Schmidt, V. (2001): Neue öko-faunistische Aspekte zum Heldbock Cerambyx cerdo L. (Col. Cerambycidae). Hercynia N.F. 34: 286-288
- Nicolescu, V.-N.; Vor, T.; Mason, W.L. et al. (2020): Ecology and management of northern red oak (Quercus rubra L. syn. Q. borealis F. Michx.) in Europe: a review. – Forestry 93: 481-494
- Nieukerken, E.J.; Doorenwerd, C.; Ellis, W. N.; Huisman, K.J.; Koster, J.C.; Mey, W.; Muus, T.S.; Schreurs, A. (2012): Bucculatrix ainsliella Murtfeldt a new North American invader widespread on northern red oaks (Q. rubra) in West-Europe (Bucculatricidae). Nota Lepid. 35 (2): 135-159
- Novius, Mitteilungsblatt der Fachgruppe Entomologie Berlin 23, 524-534
- Oleksa, A.; Klejdysz, T. (2017): Could the vulnerable great Capricorn beetle benefit from the introduction of the non-native red oak? – J. Insect. Conserv. 21: 319-329
- Petrillo, H.A. (2006): Carabid beetle acitivit-density and diversity in Northern hardwood Forests. – The Influence of forest type, disturbance, and microhabitat features on carabid density and diversity in Northern hardwood forests. Diss. Univ. Michigan, Ann Arbor, 108 S.
- Ramisch, F. (2013): Der Neophyt Roteiche (Quercus rubra L.) – eine neue Nahrungspflanze von Drymonia velitaris (Hufnagel, 1766) in Brandenburg (Lepidoptera: Notodontidae). Märkische Ent. Nachrichten 15 (1): 77–78
- Roloff, A.; Grundmann, B.M. (2008): Waldbaumarten und ihre Verwendung im Klimawandel. Archiv für Forstwesen und Landschaftsökologie 42, 97-109
- Roloff, A. (2025): Baum des Jahres 2025: die Roteiche, AFZ & Der Wald, 4, S. 12-15
- Schadewaldt, G. (2017): Gallen von Gallwespen an Eiche in einer städtischen Grünanlage, Jb. Nass. Ver. Naturkunde 138, S. 37-68
- Schuch, S.; Kahnis, T.; Floren, A.; Dorow, W.H.O.; Rabitsch, W.; Gosner, M.M.; Blank, S.M.; Liston, A.; Segerer, A.H.; Sobczyk, T.; Nuss, M. (2024): Die Bedeutung von Gehölzen für einheimische, phytophage Insekten. Natur und Landschaft 99 (4): 174-179
- Sander, I.L. (1990): Quercus rubra L. – Northern Red Oak. – in: Burns, R.M. & Honkala, B.H. (Hrsg): Silvics of North America. Vol. 2: Hardwoods. – Agriculture Handbook 654
- Sobczyk, T. (2019): Rot-Eiche (Quercus rubra) und phytophage Schmetterlingsarten (Lepidoptera) – ist die Rot-Eiche eine Alternative zu heimischen Eichen-Arten? Naturschutz und Landschaftspflege in Brandenburg 28(4): 32-39
- Stanek, M.; Piechnik,L.; Stefanowicz, A. (2020): Invasive red oak (Quercus rubra L.) modifies soil physicochemical properties and forest understory vegetation. – Forest Ecology and Management. 472. 118253. 10.1016 & j.foreco.2020.118253
- Stanek, M.; Stefanowicz, A.M. (2019): Invasive Quercus rubra negatively affected soil microbial communities relative to native Quercus robur in a semi-natural forest. – Science of the total environment 696 133977
- Starfinger, U.; Kowarik, I. (2008): Quercus rubra L. (Fagaceae), Rot-Eiche. Bundesamt für Naturschutz, http: & & www.neobiota.de & 12629.html
- Turcek, F. (1961): Ökologische Beziehungen der Vögel und Gehölze, Bratislava, 330 S.
- Vele, A.; Velova, L.; Plewa, R.; Tuf, I.H.; Mikovcova, A.; Brestovanska, T.; Rada, P.; Mock, A.; Horak, J. (2023): From leaf litter to crowns: Response of animal biodiversity to native and nonnative oak vegetation. – Forest Ecol. Manage. 534 (2023) 120856
- Vogel, S.; Busler, H.; Finnberg, S.; Muller, J.; Stengerl, E.; Thorn, S. (2020): Diversity and Conservation of saproxylic beetles in 42 European tree species: an experimental approach using early successional stages of branches. Insect Conservation and Diversity 14:132-143
- Volk, H. (2004): Grundlagen für Planung und Monitoring geschützter Waldgebiete. – Ber. Freiburger Forstliche Forschung H. 58: 9-22
- Wissenschaftlicher Dienst des Deutschen Bundestages (2018): Dokumentation zur Förderung fremdländischer Baumarten in heimischen Wald- und Forstgebieten, Wissenschaftliche Dienste, Deutscher Bundestag, WD 8 - 3000 - 112 & 18, 13 S.
- Wittland, W. (2014): Aktuelle Verbreitung der nordamerikanischen Art Bucculatrix ainsliella (Murtfeldt, 1905) in Deutschland (Lep. Bucculatricidae). Melanargia 26 (4): 204-213
- Woziwoda, B.; Kopec, D.; Witkowski, J. (2014a): The negative impact of intentionally introduced Quercus rubra L. on a forest community. – Acta. Soc. Bot. Pol. 83(19): 39-49
- Woziwoda, B.; Potocki, M.; Sagan, J.; Michal, Z.; Tomusiak, R.; Wilczynski, S. (2014b): Commercial forestry as a vector of alien tree species – the case of Quercus rubra L. introduction in Poland. – Baltic J. Forestry 20(1): 131-141
- Woziwoda, B.; Staniaszek-Kik, M.; Stefanska-Krzacek, E. (2017): Assemblages of native bryophytes in secondary forests with introduced Quercus rubra. – Nordic J. Bot. 35: 111-120
- Woziwoda, B.; Dyderski, M.K.; Greda, A.; Frelich, L.E. (2023): Verified hypotheses on the »nurse« and »burial« effects on introduced Quercus rubra regeneration in a mesic Scots pine Forest. – Ecology and Evolution;14:e11185
Beitrag zum Ausdrucken
Weitere Informationen
Autoren
- Dr. Stefan Muller-Kroehling
- Olaf Schmidt



